Il carcinoma pancreatico
Il carcinoma del pancreas esocrino è una neoplasia particolarmente aggressiva la cui incidenza è aumentata progressivamente nelle nazioni industrializzate. Nel 95% dei casi origina dalle cellule che rivestono i dotti escretori (cellule duttali). Compare prevalentemente a carico della testa-processo uncinato del pancreas (60-70% dei casi) ma può interessare l’istmo o il corpo-coda.
Come incidenza, il cancro del pancreas è il dodicesimo cancro al mondo con la stessa incidenza del cancro del rene mentre come mortalità è attualmente al quarto posto in Europa e negli stati Uniti. Si stima che con il trend attuale salirà al secondo posto entro il 2030. L’incidenza del cancro del pancreas negli Stati Uniti, dove esistono registri tumori che coprono una percentuale importante della popolazione, è stata pari a circa 12 per 100.000 abitanti/anno nel periodo 2014-2018, mentre la mortalità per cancro del pancreas nello stesso periodo è stata di 11 per 100.000 abitanti per anno. L’incidenza è anche aumentata progressivamente di circa l’1% per anno e la mortalità di circa lo 0.2% per anno. La sopravvivenza attuale a 5 anni è la più bassa di tutti i cancri e si attesta attualmente intorno al 7-8%. Questo spiega la differenza di posizione del cancro del pancreas tra incidenza (decimo) e causa di morte (quarto).
In Italia i dati di incidenza e mortalità sono sovrapponibili a quelli degli Stati Uniti.
L’importanza di questo tumore è accresciuta dal fatto che dal 2001 al 2018 la sopravvivenza ad un anno e a cinque anni è migliorata, ma solo in misura minima, passando dal 24 al 37% ad un anno e dal 4% al 7% a cinque anni. Il miglioramento degli strumenti diagnostici, che ha ridotto l’intervallo tra l’inizio dei sintomi e la diagnosi di malattia, ha migliorato solo in modo modesto la prognosi, miglioramento principalmente legato ai pazienti sottoposti a resezione chirurgica, la cui percentuale rimane comunque bassa, ed ai progressi della chemio-raadioterapia.
L’eliminazione di fattori cancerogeni anche per il pancreas come il fumo e la progressiva individuazione e utilizzazione dei fattori di rischio potrebbe permettere da un lato una prevenzione primaria della malattia, dall’altro una diagnosi più precoce e un trattamento più efficace.
Purtroppo no. I marcatori tumorali noti non sono utilizzabili per lo screening perché potrebbero non essere elevati sia nel 10% circa dei pazienti con cancro del pancreas incluso nella popolazione in studio (falsi negativi) che in un certo numero di soggetti sani (falsi positivi) che, a parte lo spavento, dovrebbero quindi sottoporsi a indagini morfologiche (ECO, TAC, …) per escludere la presenza del cancro. Aumentando il numero di indagini morfologiche aumenta anche il numero di falsi positivi (diagnosi di cancro in soggetti sani) con le conseguenze che è facile immaginare. Si spera che gli studi in corso sulle alterazioni genetiche cellulari che compaiono precocemente durante la graduale trasformazione delle cellule normali in cellule carcinomatose possa fornire soluzioni efficaci. In particolare si mira a sfruttare la possibilità di rilevare i prodotti dei geni modificati nelle feci, nella bile e/o nel sangue. In ogni caso l’incidenza relativamente bassa del cancro del pancreas renderà necessario eseguire lo screening solo in soggetti selezionati, portatori di riconosciuti fattori di rischio.
Sfortunatamente, in stadio precoce, il carcinoma del pancreas è asintomatico o causa solo sintomi aspecifici che di solito sono attribuiti ad altre cause. Sintomi più caratteristici si presentano quando il tumore è cresciuto ed ha invaso altri organi e/o comprime i dotti biliari. Questi sintomi comprendono: il calo di peso, la diminuzione o la perdita dell’appetito (anoressia), il dolore epigastrico (alla bocca dello stomaco) irradiato a cintura fino al dorso, l’ittero (ossia una colorazione gialla delle sclere, della cute e delle mucose visibili dovuta ad accumulo della bilirubina nel sangue), astenia (debolezza), nausea e vomito. La sintomatologia varia secondo la sede di origine della neoplasia, essendo più precoce per i tumori della testa-processo uncinato del pancreas e decisamente più tardiva per quelli del corpo-coda. L’insorgenza o il rapido peggioramento di un diabete in soggetti adulti, in assenza di fattori predisponenti quali familiarità e obesità, deve indurre a eseguire un’accurata esplorazione morfologica del pancreas. Anche il dolore, quando presente, può aiutare a porre la diagnosi: si tratta di un dolore continuo, spesso esacerbato dai pasti, fastidioso soprattutto di notte, localizzato all’epigastrio e irradiato verso destra o verso sinistra o da entrambi i lati fino al dorso. Purtroppo è un sintomo tardivo della malattia che spesso, prima di essere attribuito al pancreas, viene attribuito allo stomaco (con conseguente gastroscopia) al colon (con conseguente colonscopia) o all’artrosi lombare tipica delle persone anziane.
Fra i molti marcatori bioumorali proposti di volta in volta per sospettare la diagnosi di carcinoma pancreatico nessuno può essere considerato utile per una diagnosi precoce di questa neoplasia. Questo perché, nelle fasi iniziali della malattia, è piuttosto frequente riscontrare livelli normali o solo lievemente aumentati dei vari marcatori che risultano pertanto di scarsa utilità. Negli stadi più avanzati della neoplasia si trovano livelli aumentati di questi indici in circa tre/quarti dei casi. Il marcatore più sensibile e specifico di carcinoma del pancreas è il CA 19-9. Si tratta di una glicoproteina di membrana che è prodotta dalle cellule tumorali in maniera abbastanza direttamente proporzionale al numero di cellule neoplastiche presenti sia nel tumore primitivo sia nelle eventuali metastasi. Va tenuto presente che, nella valutazione di un valore elevato di questo indice bisogna considerare l’eventuale presenza d’ittero. Dato che il metabolismo del CA 19-9 avviene a livello epatico, una sofferenza del fegato legata all’ittero (anche per patologia benigna come ad esempio un calcolo che ostruisce il coledoco) può determinare un ridotto metabolismo epatico del CA 19-9 con conseguente aumento, anche molto elevato, del marcatore nel sangue. Il CA 19-9 ha un ruolo importante nel monitoraggio della terapia sia medica che chirurgica. Infatti, i livelli diminuiscono progressivamente in risposta ad una chemioterapia efficace e si normalizzano dopo l’asportazione chirurgica radicale del tumore. Al contrario, i livelli possono continuare ad aumentare in corso di una chemioterapia poco efficace, oppure rimanere elevati anche dopo un intervento eseguito con intento radicale, segnalando la presenza di malattia residua non visibile con le indagini morfologiche disponibili. Infine, i marcatori che riprendono ad aumentare dopo essersi normalizzati, o dopo una diminuzione importante, segnalano abitualmente la ripresa della malattia a livello locale e/o a distanza. Va infine ricordato che il 10% circa della popolazione non è in grado di produrre il CA 19-9 e che esistono cancri del pancreas che hanno perduto la capacità di produrre il CA 19-9. Questo può spiegare valori normali del CA 19-9 pur in presenza di una malattia conclamata.
Non esistono esami bioumorali specifici per il carcinoma pancreatico. Molto spesso tutti gli indici bioumorali sono nella norma. Tuttavia in caso d’interessamento epatico (per ittero ostruttivo e/o metastasi) potranno essere rilevati aumenti della bilirubina, della fosfatasi alcalina, della gamma-GT e delle transaminasi.
Il dosaggio nel sangue degli enzimi pancreatici (amilasi e lipasi) non aiuta nella diagnosi di carcinoma del pancreas: essi sono spesso nella norma o mostrano modeste elevazioni che possono essere riscontrate anche in corso di pancreatite cronica o in alcuni soggetti normali per aumento dell’amilasi legata alle proteine del sangue e quindi più lentamente eliminabile. In ogni caso, l’elevazione improvvisa di uno o di entrambi gli enzimi pancreatici in precedenza normali deve suggerire un accurato approfondimento morfologico.
Al momento della diagnosi di carcinoma pancreatico bisogna valutare attentamente se la neoplasia è limitata al pancreas o ha già dato metastasi, ossia abbia raggiunto altri organi vicini o lontani (linfonodi, vasi sanguigni, fegato). L’interessamento loco-regionale e/o a distanza determina la possibilità o meno di intervenire chirurgicamente con intento radicale. In altri termini, una corretta stadiazione della malattia stabilisce se la neoplasia è resecabile oppure no
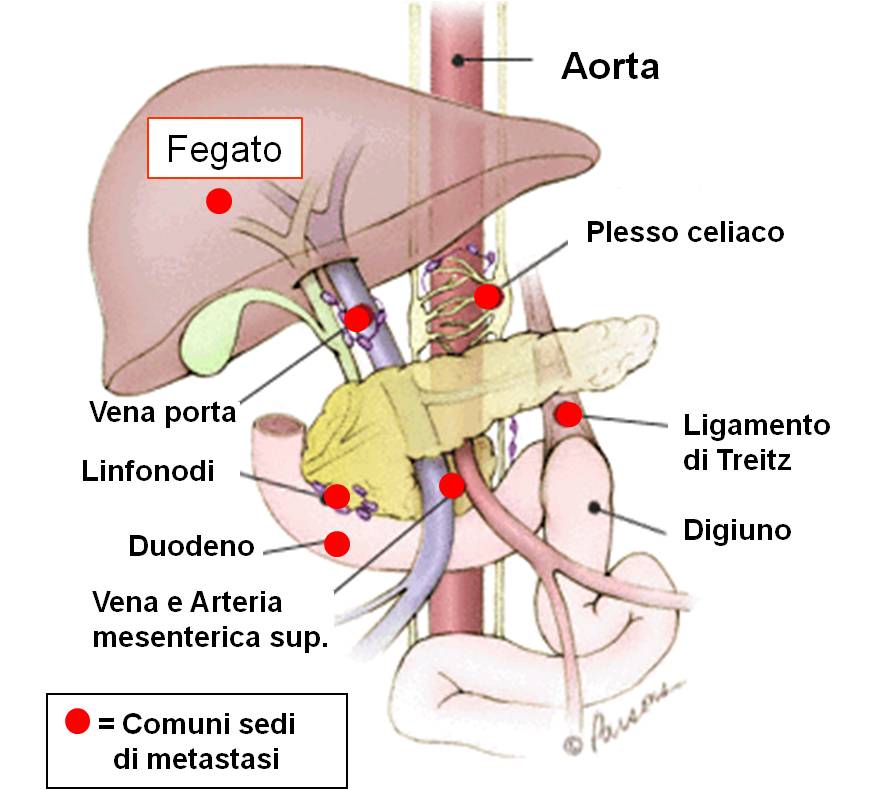
Sedi comuni di metastasi
Qualora i sintomi facciano sospettare la presenza di un carcinoma pancreatico, vi sono diversi esami strumentali che possono essere eseguiti per confermare la diagnosi:
1. ECOGRAFIA EPATO-BILIO-PANCREATICA
La prima indagine che deve essere eseguita è l’ecografia. Essa è diventata il mezzo più rapido, meno costoso e più facilmente disponibile per scoprire eventuali lesioni pancreatiche e/o relative metastasi epatiche nei pazienti.
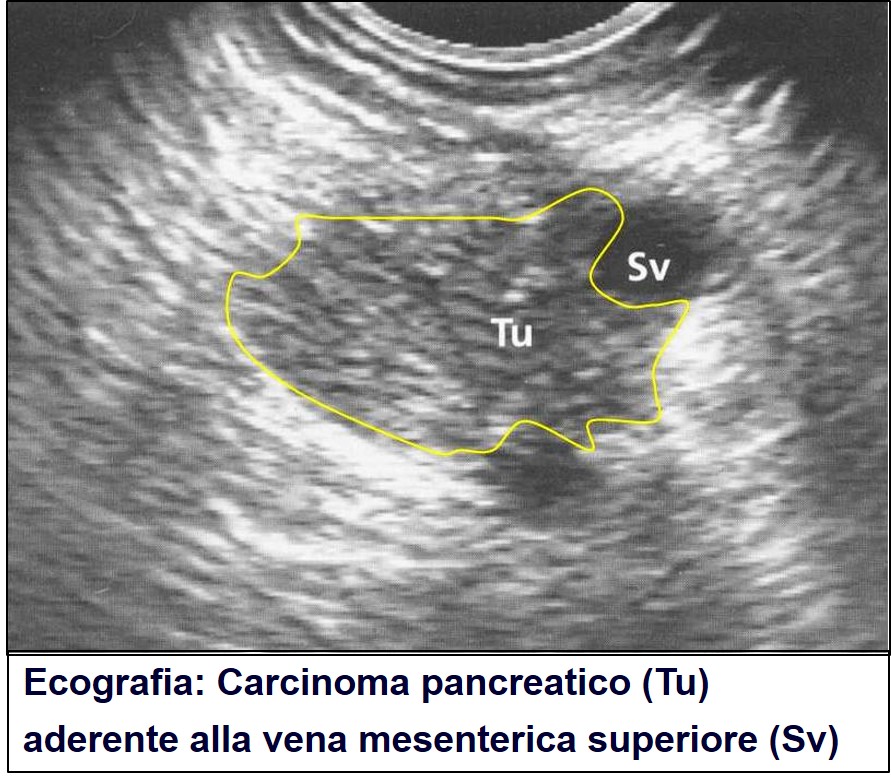
Ecografia
Nata a metà degli anni ’70 del secolo scorso ha raggiunto altissimi livelli di definizione delle lesioni pancreatiche. Si tratta tuttavia di un esame fortemente operatore dipendente ed è quindi necessaria una grande esperienza del Radiologo per ottenere una sensibilità del 76% (che significa diagnosticare tre cancri su quattro) e una specificità del 91% (che significa porre un' errata diagnosi di sospetta massa pancreatica in un paziente sano ogni dieci esaminati). Il risultato può essere ulteriormente migliorato con l’iniezione di mezzo di contrasto, procedura abitualmente appannaggio di centri specialistici. Ovviamente questi risultati sono ottenuti da radiologi molto esperti. In mani meno esperte il margine di errore aumenta anche notevolmente. Il tumore che sfugge più facilmente all’ecografista è quello inferiore ai 2 cm di diametro e quello, anche un po’ più voluminoso, localizzato a livello della coda del pancreas vicino alla milza. Se negativa, può essere sufficiente a escludere il carcinoma pancreatico se il quadro clinico è piuttosto vago e inconsistente. In caso contrario si deve proseguire le indagini con una TAC o una RMN.
2. TOMOGRAFIA COMPUTERIZZATA ADDOME SUPERIORE CON MEZZO DI CONTRASTO (mdc)
La TAC ha fatto la sua comparsa verso la fine degli anni ’70 del secolo scorso. Da allora i progressi sono stati enormi ed è attualmente considerata la più utile tecnica d’immagine per la diagnosi di carcinoma pancreatico. La TC spirale consente di ottenere immagini tridimensionali di tutti gli organi addominali e di visualizzare non solo la massa tumorale pancreatica ma anche eventuali metastasi epatiche e/o linfonodali. L’accuratezza diagnostica è buona (è in grado di visualizzare nove tumori pancreatici su dieci) ma diminuisce con il diametro del tumore: più piccolo è il tumore e maggiore è il rischio che sfugga all’indagine.
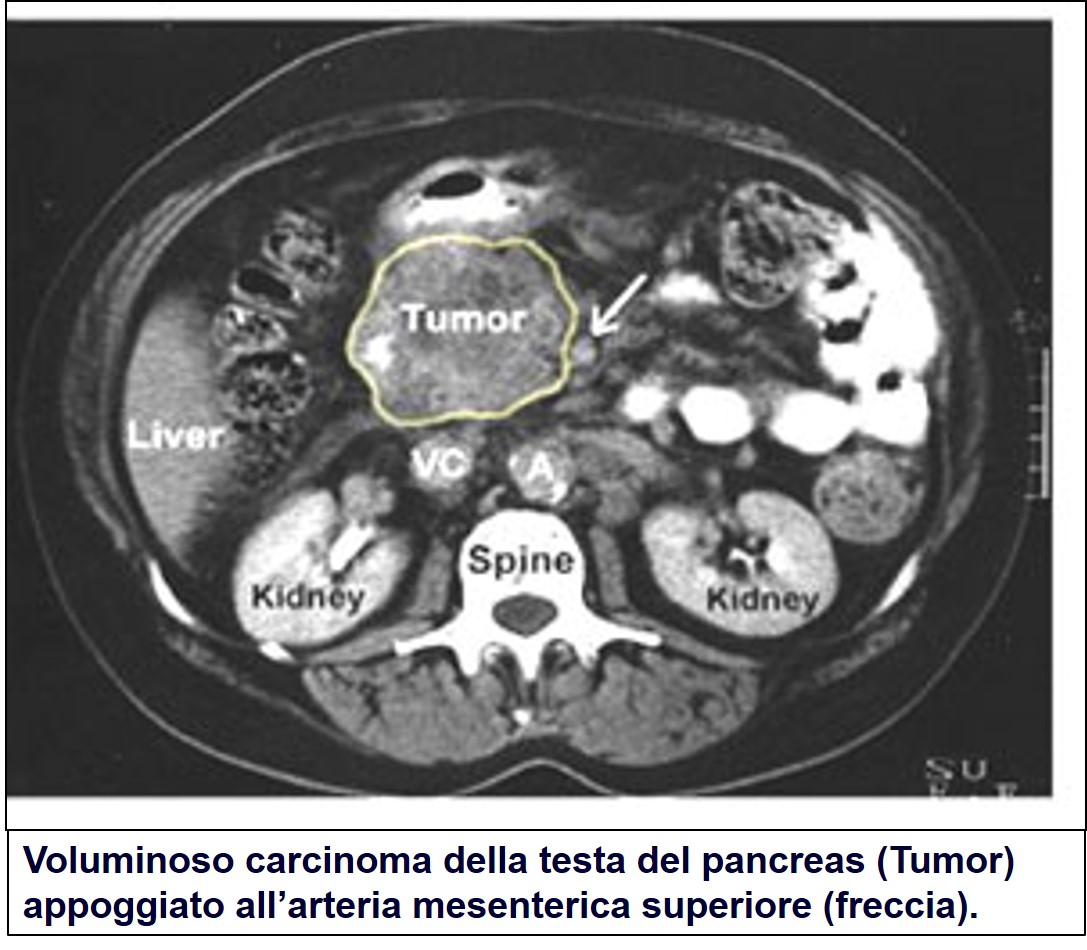
TAC di carcinoma pancreatico
Pertanto, la principale limitazione è rappresentata dalle dimensioni della massa, anche se questa metodica è in grado di definire lesioni occupanti spazio inferiori a 1 centimetro. In caso di negatività l’esame è in grado di escludere il cancro del pancreas con notevole accuratezza. In caso di negatività della TAC eventuali ulteriori indagini (RNM, Ecoendoscopia) vanno eseguite solo in presenza di un consistente sospetto clinico. La TAC spirale, se ben eseguita, è inoltre in grado di definire la resecabilità del tumore con un’accuratezza compresa tra il 75% e il 90%. I livelli di radiazione cui il soggetto è esposto sono modesti e, se si esclude il rischio di reazione allergica al mezzo di contrasto (inferiore all’1% dei pazienti), è un esame scevro da complicazioni.
3. RISONANZA MAGNETICA NUCLEARE (RMN)
Comparsa alla fine degli anni ’80 del secolo scorso per l’uso clinico, anche la RNM ha fatto progressi incredibili in relativamente breve tempo.
Si tratta di una metodica poco invasiva che sfrutta la creazione di potenti campi magnetici per provocare reazioni diverse in tessuti diversi. Il rilievo di queste reazioni a rapide modificazioni del campo magnetico consente di distinguere i diversi tessuti presenti nell’area presa in esame. In particolare, è in grado di distinguere i liquidi, contenuti nei vasi o nei dotti, dalle strutture solide (fegato, pancreas, milza, pareti intestinali, etc.). In questo modo può essere ricostruita la conformazione dei dotti biliari e pancreatici senza ricorrere all’iniezione diretta di mezzo di contrasto con metodiche più invasive (ERCP, PTBD. Vedi più avanti). Inoltre l’iniezione di secretina (un potente ormone che stimola la secrezione pancreatica) può consentire una migliore visualizzazione del Wirsung e una sia pur grossolana valutazione funzionale del pancreas esocrino. Si tratta della metodica di prima scelta per lo studio delle vie biliari e pancreatiche, anche perché consente di visualizzare i dotti a monte di eventuali stenosi non superabili dal mezzo di contrasto iniettato mediante ERCP (vedi più avanti).
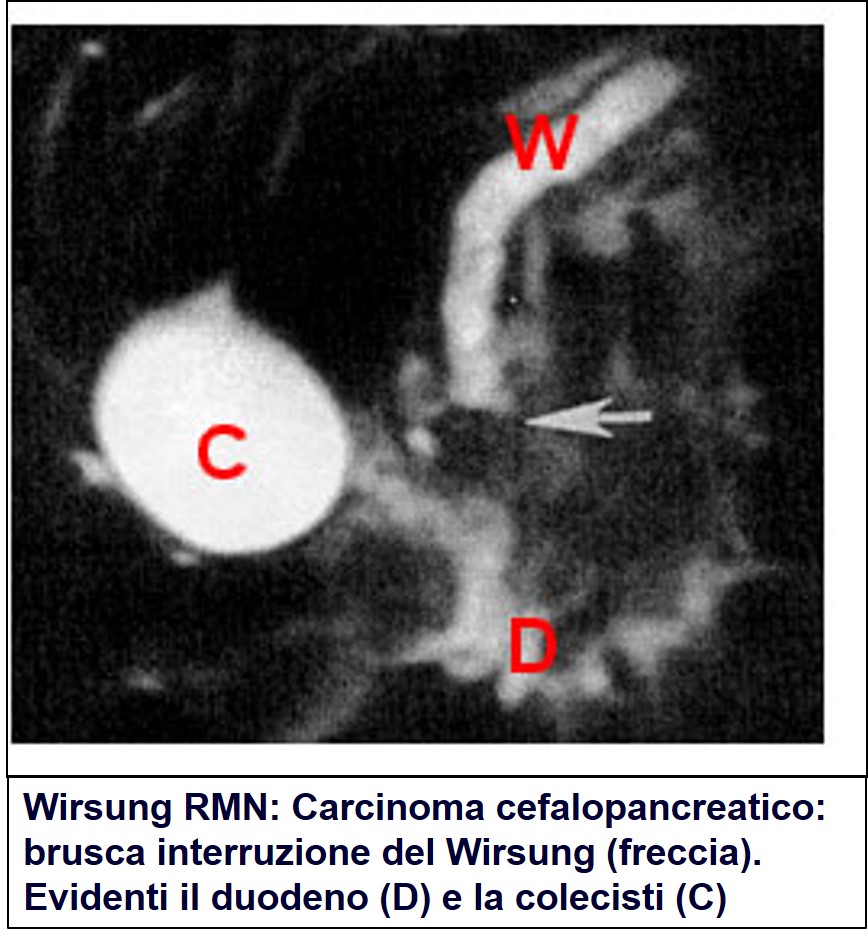
Wirsung RMN di carcinoma pancreatico
Essa è inoltre in grado di visualizzare il tumore e di definire i suoi rapporti con i grossi vasi peri pancreatici. Viene per lo più utilizzata sia nei casi in cui la TAC non consenta di dirimere il dubbio diagnostico, sia per definire la resecabilità nei casi in cui la TAC non fornisca informazioni sufficienti. Non può essere eseguita in soggetti che abbiano all’interno del corpo oggetti metallici (schegge metalliche, valvole cardiache di vecchio tipo, pace-maker, etc.) sensibili alle variazioni di campo magnetico.
4. ECOENDOSCOPIA
Introdotta all’inizio degli anni ’90 del secolo scorso, è una procedura più invasiva delle precedenti ed è basata sulla possibilità di utilizzare sonde ecografiche ad alta frequenza (e di conseguenza a elevata definizione) che non potrebbero essere utilizzate per studiare il pancreas attraverso la parete addominale dato che la loro bassa penetrazione non consentirebbe di visualizzare il pancreas.
In pratica la sonda è montata su un endoscopio che viene introdotto sotto controllo visivo in stomaco e duodeno. Una volta appoggiata alle pareti dello stomaco o del duodeno consente di eseguire un’ecografia a elevata definizione della parete gastro-duodenale e delle strutture, come il pancreas e le vie biliari extraepatiche, che si trovano a stretto contatto con lo stomaco o il duodeno. Come l’ecografia, è un’indagine altamente operatore dipendente, basata su di un equipaggiamento sofisticato e costoso la cui diffusione è ancora relativamente limitata.
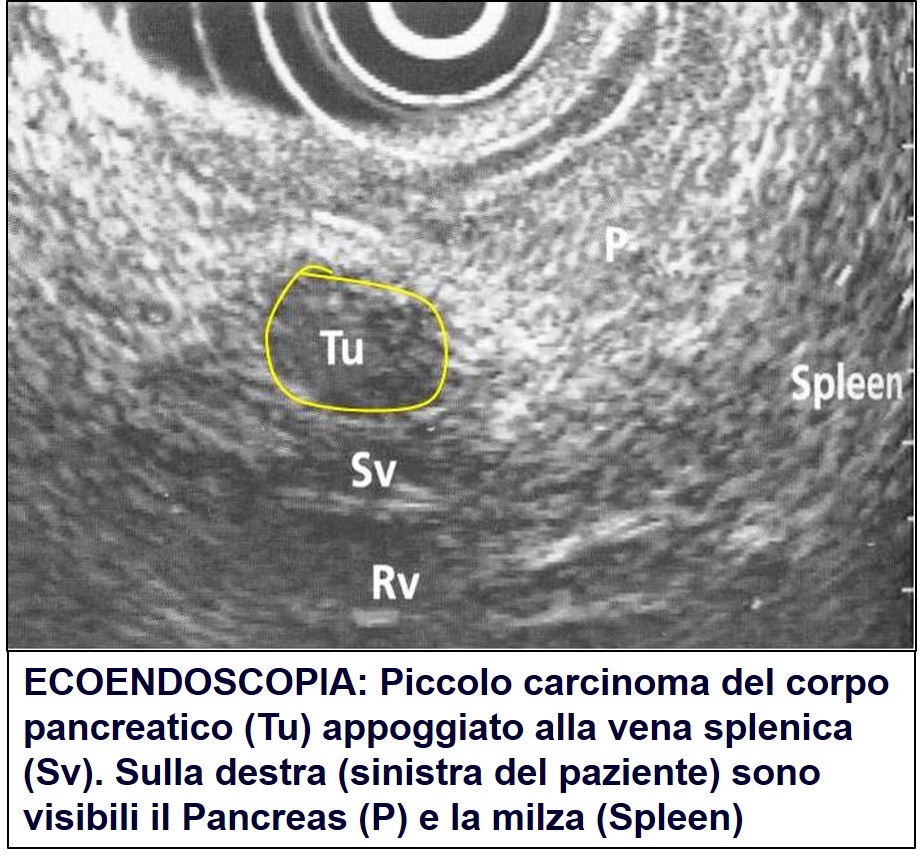
Ecoendoscopia di carcinoma pancreatico
È utilizzata per dirimere con ragionevole certezza i casi che TAC e RNM non hanno consentito di definire. Inoltre è utilizzata per il prelievo di tessuto (o di liquido in caso di lesione cistica) per una definizione istologica (o citologica) della malattia e per distruggere, in casi particolari, con la radiofrequenza buona parte del cancro della testa del pancreas.
5. ERCP (COLANGIOPANCREATOGRAFIA RETROGRADA ENDOSCOPICA)
E’ un esame combinato endoscopico e radiologico che permette di visualizzare i dotti pancreatici e biliari e di eseguire l’esame citologico del materiale ottenuto per aspirazione o spazzolamento.
Il mezzo di contrasto è iniettato direttamente nei dotti tramite un catetere introdotto attraverso l’ampolla di Vater (dove il dotto biliare e pancreatico sboccano nel duodeno) per mezzo di un endoscopio modificato a visione laterale.
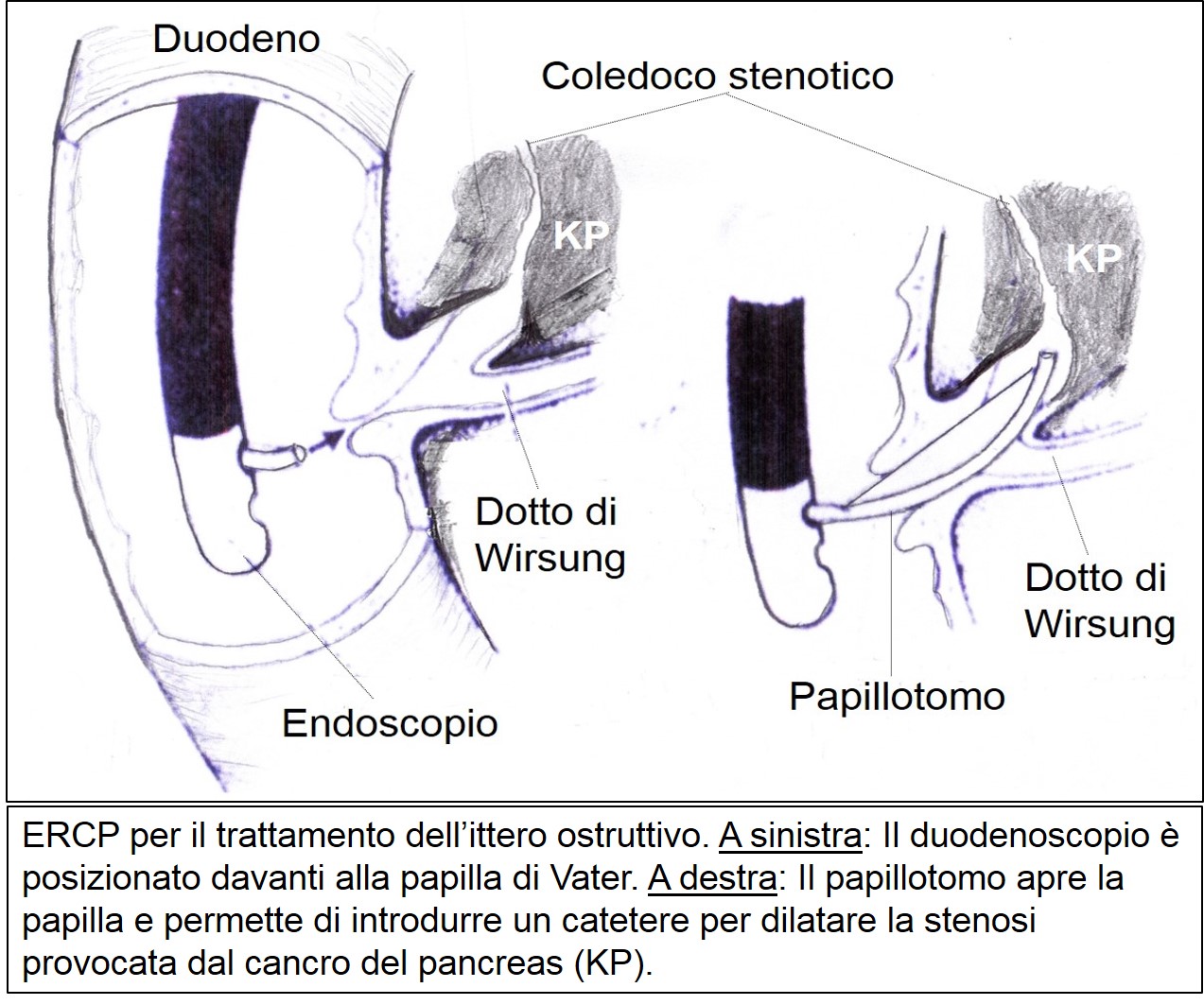
ERCP per ittero ostruttivo
L’ERCP è un esame complesso e invasivo che può avere delle complicazioni importanti quali la pancreatite acuta, la perforazione del duodeno, l’infezione delle vie biliari e il sanguinamento nel 2-5% dei casi con una mortalità dello 0,5%. Deve essere pertanto eseguito solo in assenza di alternative meno invasive. L’ERCP consente di dimostrare alterazioni morfologiche dei dotti (ostruzioni o stenosi irregolari del dotto di Wirsung o compressioni della porzione intra pancreatica del coledoco con dilatazione a monte) utili alla diagnosi. Il suo ruolo diagnostico è stato in gran parte sostituito dalla RMN, mentre rimane attuale l’uso terapeutico. L’ERCP consente di posizionare (e di sostituire al bisogno) protesi biliari (tubicini di plastica o metallici) che, superando la stenosi del coledoco dovuta al cancro, garantiscono il passaggio della bile in duodeno risolvendo così l’ittero ostruttivo.
6. PTBD (DRENAGGIO PERCUTANEO TRANSEPATICO delle vie BILIARI).
Si tratta di una metodica radiologica decisamente invasiva utilizzata in caso di ittero ostruttivo che non è stato possibile drenare mediante ERCP. La PTBD consiste nella puntura delle vie biliari sotto guida ecografica attraversando la parete addominale ed il fegato. Attraverso l’ago viene fatto passare un filo guida che consente, mediante l’uso di dilatatori di calibro crescente, di introdurre un catetere nelle vie biliari dilatate. La bile viene quindi drenata all’esterno e questo consente una graduale normalizzazione della bilirubinemia. Per evitare una eccessiva perdita di liquidi e proteine, si procede al passo successivo che consiste nel posizionare una endoprotesi attraverso il tratto stenotico della via biliare che consenta il passaggio della bile in duodeno. Il superamento della stenosi con un filo guida, necessario al posizionamento dell’endoprotesi, può a volte non riuscire
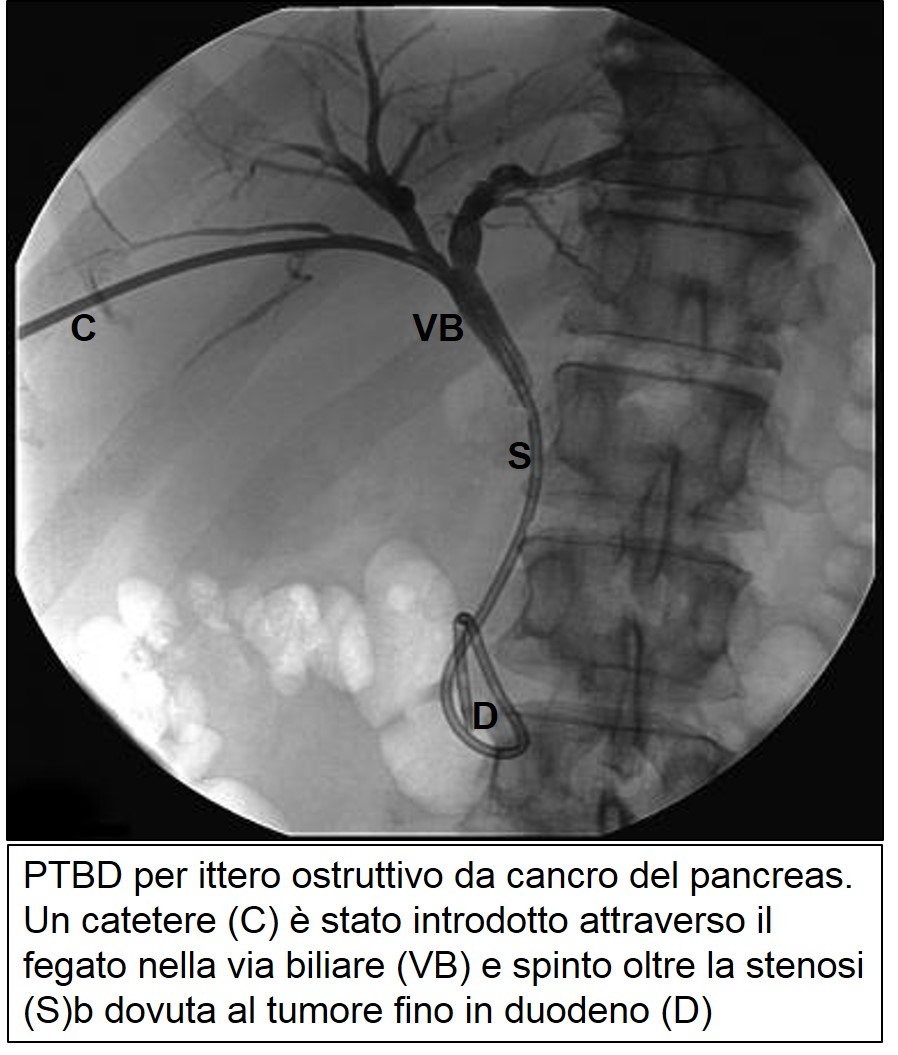
PTBD di carcinoma pancreatico
7. PET (TOMOGRAFIA A EMISSIONE DI POSITRONI)
E’ una metodica ancora poco utilizzata nel carcinoma pancreatico sia per il costo elevato, sia per il numero limitato di Centri in grado di eseguirla. Essa sfrutta la captazione del F18–desossiglucosio (18FDG) che è scambiato dalle cellule per glucosio. Il 18FDG rimane intrappolato a lungo nelle cellule consentendo di ottenere una mappa funzionale del “tracciante”. Quanto maggiore è la captazione del tracciante, tanto maggiore è il consumo di glucosio da parte della cellula. Tipicamente le cellule carcinomatose, incluse quelle del cancro del pancreas, hanno un consumo di glucosio più elevato di quelle dei tessuti normali circostanti. Il cancro del pancreas e le eventuali metastasi possono così essere dimostrati dalla PET come aree d’elevato accumulo del tracciante.
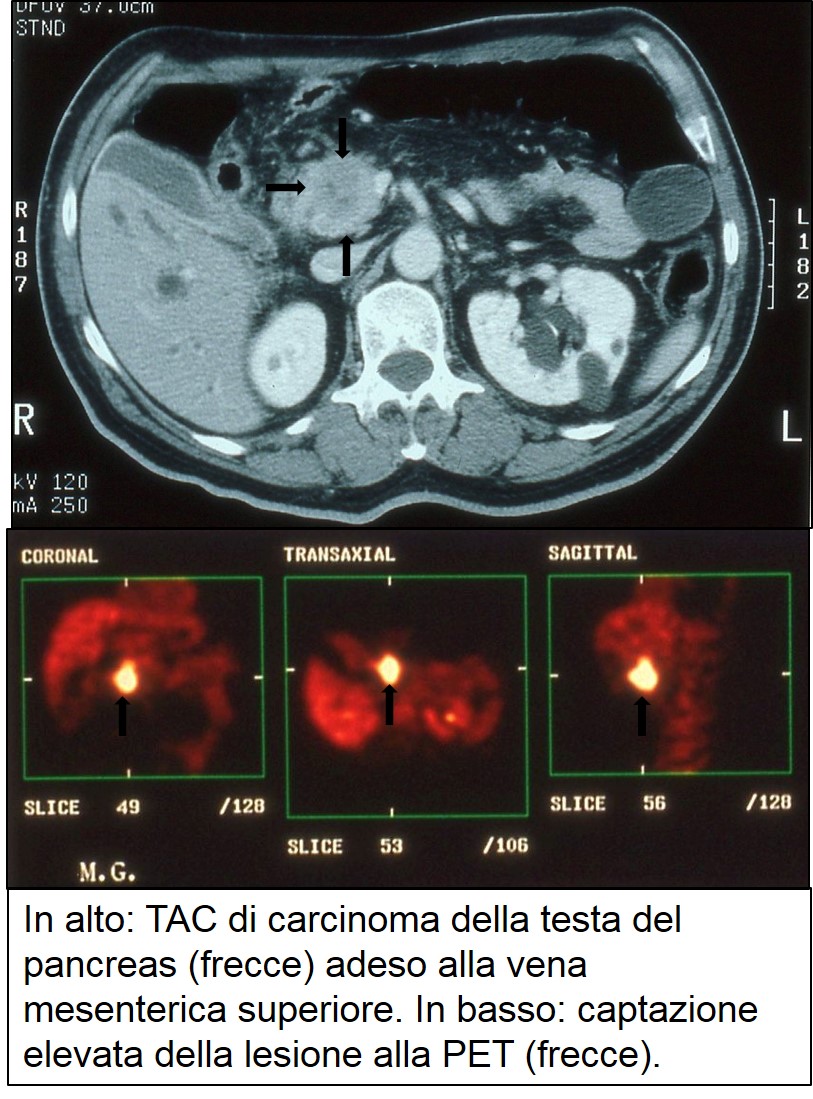
TAC e PET di carcinoma cefalo pancreatico
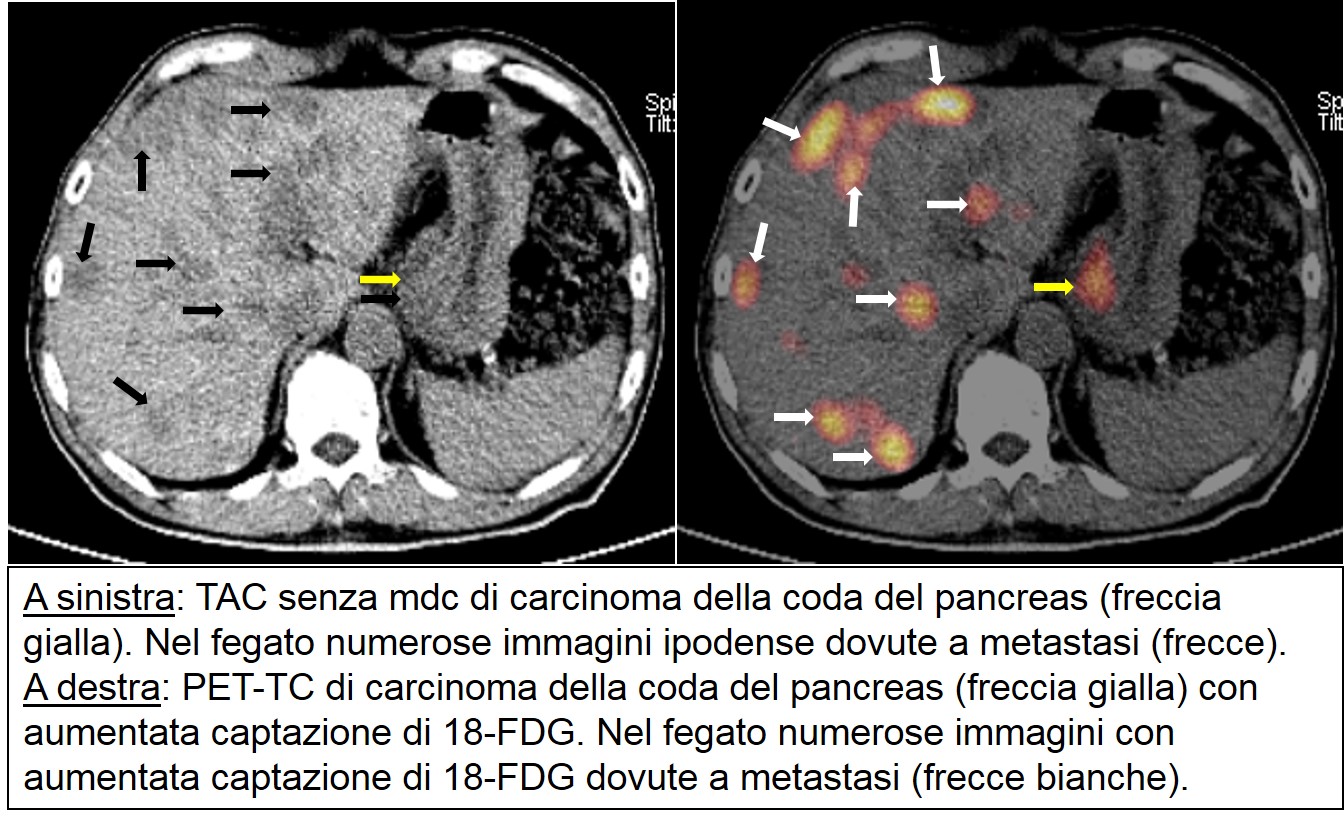
PET-TC di carcinoma cefalopancreatico
Dato che anche le cellule infiammatorie hanno un elevato consumo di glucosio, la PET può risultare positiva anche in caso di riacutizzazione di una pancreatite cronica, rendendo impossibile, in un significativo numero di pazienti, la diagnosi differenziale più utile dal punto di vista clinico. Trattandosi di un’indagine funzionale, con la PET era difficile localizzare con precisione l’area patologica. Da alcuni anni sono entrate in funzione le PET-TAC che sfruttano l’associazione dei due strumenti per una localizzazione precisa dell’area patologica. La PET-TAC è anche utilizzata nel follow-up dei pazienti resecati per individuare precocemente la sede e l’estensione della recidiva. E’ stata anche proposta per monitorizzare precocemente l’efficacia o meno della chemioterapia. Nel cancro del pancreas, a un aumento della captazione del tracciante corrisponde abitualmente un aumento dell’aggressività del tumore.
Fumo di sigaretta
Il fumo di sigaretta è il principale fattore di rischio noto per l’adenocarcinoma del pancreas. Il fumo di sigaretta contiene una gran quantità di carcinogeni: amine aromatiche, nitrosamine tabacco-specifiche, agenti alchilanti, idrocarburi policiclici aromatici e amine aromatiche eterocicliche. La carcinogenesi legata al fumo di sigaretta potrebbe essere dovuta al danno ossidativo al DNA cui segue l’attivazione degli oncogeni e la disattivazione di geni oncosoppressori (vedi fattori genetici). Si stima che sia responsabile del 25-30% dei casi di carcinoma pancreatico.
Età e sesso
Il carcinoma del pancreas colpisce in egual misura maschi e femmine. Questo dato trova spiegazione nell’aumento di frequenza del carcinoma pancreatico soprattutto nel sesso femminile, probabilmente collegato a un aumento del consumo di sigarette da parte delle donne. Nel 70% dei casi si manifesta tra i sessanta e gli ottanta anni mentre i casi sotto i quaranta anni d’età sono molti rari
Fattori ambientali
Vi sono paesi a elevata mortalità, quali Stati Uniti, Paesi Scandinavi e Scozia, mentre i tassi sono leggermente più bassi in Giappone e Italia. Tuttavia i giapponesi emigrati negli Stati Uniti presentano una mortalità quattro volte maggiore rispetto a quella dei residenti in Giappone e doppia rispetto agli statunitensi, suggerendo un ruolo importante dei fattori ambientali. Non sembra esservi rapporto con lo stato socio-economico, ma la mortalità tende ad aumentare con l’urbanizzazione. L’incidenza del cancro del pancreas nella regione Veneto è particolarmente elevata, superiore anche a quella degli Stati Uniti.
Fattori nutrizionali
E’ stato segnalato un aumento di rischio di carcinoma pancreatico per diete ricche di carne e grassi. In un recente studio americano, cui hanno partecipato 88.802 donne, sono stati diagnosticati in diciotto anni di follow-up 180 casi di carcinoma pancreatico. Il rischio era aumentato nelle donne che introducevano giornalmente elevate quantità di glucosio o di fruttosio con gli alimenti. Questa associazione era ancora più evidente tra le donne obese e che avevano uno stile di vita sedentario. Si stima che contribuiscano al 20% circa dei casi di carcinoma pancreatico.
Alcool
I dati epidemiologici sono contrastanti. Alcuni studi hanno mostrato un aumento del rischio nei bevitori, altri nessuna differenza rispetto ai non bevitori. In un recente studio svedese, è stato dimostrato che gli alcolisti hanno solo un lieve aumento di rischio (1,4 volte rispetto ai non bevitori) di sviluppare un carcinoma pancreatico.
Caffè
E’ stata dimostrata un’associazione tra un elevato consumo giornaliero di caffè (>4 / die) e rischio di morte per carcinoma pancreatico.
Fattori professionali
Alcune categorie professionali sembrano avere un rischio aumentato di neoplasia del pancreas: chimici, garagisti, addetti a distributori di benzina, soggetti esposti a benzidina e benzilalanina.
Malattie associate
I pazienti con pancreatite cronica ereditaria muoiono nel 30 % dei casi per carcinoma del pancreas. Essendo una malattia rara, si stima che contribuisca a meno del 4 % dei casi di carcinoma pancreatico. I rapporti tra pancreatite cronica non ereditaria e cancro del pancreas sono invece più complessi. Nel caso d’associazione tra le due malattie, spesso non è chiaro se la pancreatite sia secondaria al cancro, se le due patologie condividano comuni fattori eziologici o se la pancreatite sia stato il fattore di rischio per l’insorgenza del tumore. Il riscontro di una pancreatite cronica in pazienti con caratteristiche cliniche ed epidemiologiche atipiche (esordio improvviso d’ittero, sesso femminile, età superiore a cinquanta anni, non fumatori, non bevitori, diabetici non insulino dipendenti) è stato associato a un aumentato rischio di presenza di un carcinoma pancreatico. Un aumento significativo del rischio di morte per carcinoma pancreatico è stato riscontrato in donne con storia clinica di calcolosi delle vie biliari e di colecistite. E’ da tener presente che tali condizioni patologiche sono più frequenti in caso d’obesità, che, come già descritto, aumenta il rischio di carcinoma pancreatico specie qualora vi sia associato un alterato metabolismo glucidico.
Diabete
I pazienti affetti da carcinoma pancreatico presentano, al momento della diagnosi, un’elevata incidenza d’iperglicemia o di diabete franco (fino all’ottanta per cento dei casi). Questo ha creato non pochi problemi nel definire il rischio d’insorgenza del cancro del pancreas nel paziente diabetico. Ora sappiamo che:
- I pazienti diabetici hanno un aumento del rischio di sviluppare un carcinoma pancreatico intorno al 50% rispetto ai non diabetici;
- Il cancro del pancreas può produrre sostanze responsabili dell’insorgenza o del peggioramento improvviso del diabete;
- L’asportazione completa del cancro del pancreas può determinare, in una percentuale significativa di pazienti, un miglioramento del diabete malgrado sia stata asportata una parte rilevante (40-60%) della ghiandola pancreatica.
E’ stato dimostrato che le cellule neoplastiche pancreatiche rilasciano nel sangue delle sostanze in grado di interferire con l’utilizzo del glucosio da parte dei muscoli, del fegato e forse anche da parte del tessuto adiposo.
L’insorgenza improvvisa del diabete in un paziente senza particolare familiarità, o il peggioramento improvviso del diabete in precedenza ben controllato, deve indurre il paziente a eseguire un accurato esame morfologico del pancreas.
Prevenzione del carcinoma pancreatico
Si tratta di una neoplasia difficile da prevenire poiché non se ne conoscono ancora tutte le possibili cause. In ogni caso l’eliminazione del fumo di sigaretta riduce significativamente il rischio di ammalarsi di cancro del pancreas. Anche chi smette di fumare, ottiene una riduzione del rischio, anche se lenta e progressiva tanto che diventa uguale a quello dei non fumatori solo dopo venti anni. Uno stile di vita sano che eviti gli eccessi di assunzione di alcool, caffè, cibo (per evitare l’obesità) è certamente utile a ridurre il rischio di ammalarsi di cancro del pancreas.
Per quanto riguarda la familiarità di cancro del pancreas sono in corso studi per valutare la fattibilità e l’efficacia dell’asportazione preventiva di parte o tutta la ghiandola.
La chemioterapia ha fatto la sua comparsa nel trattamento del cancro del pancreas all’inizio degli anni ’90 del secolo scorso con il 5-Fluorouracile (5-FU). Si cominciò con il trattare pazienti con malattia avanzata con scarsi risultati. Un primo salto di qualità è stato compiuto con l’ingresso della Gemcitabina nell’uso clinico e la dimostrazione di una sua maggiore efficacia rispetto al 5-FU avvenuta con la pubblicazione di uno studio prospettico nel 1997 in pazienti con carcinoma pancreatico metastatico. Tuttavia la sopravvivenza mediana (quella del cinquantesimo paziente su cento, il che significa che metà dei pazienti avevano una sopravvivenza superiore e il 50% inferiore alla mediana) era di 4,41 mesi per il 5-FU e di 5,65 mesi per la Gemcitabina. Da allora la Gemcitabina è diventata il trattamento standard contro cui confrontare qualsiasi altro tipo di trattamento. Possiamo distinguere l’uso della chemioterapia in diverse situazioni nel cancro del pancreas.
1.CARCINOMA LOCALMENTE AVANZATO O METASTATICO
E’ lo stadio del carcinoma pancreatico più frequentemente diagnosticato (>80%) che, dopo un eventuale trattamento chirurgico o endoscopico palliativo, viene affidato all’Oncologo. Il trattamento di scelta era la Gemcitabina fino a che uno studio ha dimostrato un modesto prolungamento della sopravvivenza grazie all’associazione con Erlotinib (mediana: 6,24 mesi) soprattutto a favore dei pazienti che sviluppavano rash cutaneo di grado due o più elevato. Pertanto l’associazione con Erlotinib è stata consigliata solo per i pazienti che sviluppavano rash cutaneo. Un ulteriore passo avanti è stato fatto con l’associazione di più farmaci (FOLFIRINOX: Oxaliplatino + Acido folinico +Irinotecan +5-FU) con una sopravvivenza mediana arrivata a 11,1 mesi. Si tratta tuttavia di una chemioterapia pesante proponibile solo a soggetti di età inferiore a 75 anni, in buone condizioni generali e senza ittero. Inoltre la qualità di vita dei pazienti è più pesantemente compromessa rispetto alla Gemcitabina da sola. Un studio successivo che ha arruolato anche pazienti di età superiore ai 75 anni e non tutti in buone condizioni generali ha dimostrato che l’associazione Gemcitabina + Nab-paclitaxel è più efficace della Gemcitabina da sola, con una sopravvivenza mediana di 8,5 mesi rispetto ai 6,7 mesi della Gemcitabina da sola. Benché apparentemente meno efficace del FOLFIRINOX, è molto meglio tollerata con meno effetti collaterali. In conclusione, la scelta attuale è tra FOLFIRINOX e Gemcitabina + Nab-paclitaxel ed è basata sulle condizioni generali del paziente e l’assenza di ittero.
Chemioterapia di seconda linea: quando la malattia cessa di rispondere al chemioterapico di prima scelta, un certo vantaggio nella sopravvivenza può essere ottenuto applicando un regime diverso, anche se per il momento quale seconda linea scegliere è ancora oggetto di studio.
2. CHEMIOTERAPIA ADIUVENTE DOPO RESEZIONE CHIRURGICA
L’introduzione della chemioterapia adiuvante dopo l’asportazione potenzialmente radicale del tumore è iniziata verso la metà degli anni ’90 del secolo scorso pensando di sfruttare il farmaco allora a disposizione (5-FU) per distruggere l’eventuale malattia residua. La prima dimostrazione dell’efficacia della terapia adiuvante con 5-FU ed acido folinico è stata ottenuta con lo studio ESPAC-01, cui abbiamo partecipato, nel 2004. Un altro studio, CONKO-001, pubblicato nel 2013, ha dimostrato un prolungamento della sopravvivenza con la terapia adiuvante a base di Gemcitamina. Uno studio giapponese pubblicato nel 2008 ha mostrato una maggiore efficacia di un derivato orale della Gemcitabina (S-1) rispetto alla Gemcitabina. Il dato tuttavia necessita di essere confermato da ulteriori studi. E’ stato recentemente dimostrato che l’aggiunta della Capecitabina alla Gemcitabina prolunga significativamente la sopravvivenza rispetto alla terapia adiuvante con sola Gemcitabina.
3.CHEMIO(RADIO)TERAPIA NEOADIUVANTE PRIMA DELLA RESEZIONE CHIRURGICA.
L’introduzione della chemioterapia neoadiuvante è stata basata sul fatto che un certo numero di pazienti andavano incontro a progressione rapida della malattia dopo un intervento chirurgico apparentemente radicale. Inoltre, si è considerato che la terapia adiuvante non poteva essere eseguita in un certo numero di pazienti a causa delle complicanze postoperatorie e delle conseguenti compromesse condizioni generali. Si riteneva che eseguendo la chemio(radio) terapia prima dell’intervento, i pazienti destinati ad una progressione rapida della malattia avrebbero evitato l’intervento. Inoltre l’efficacia della chemio(radio)terapia sarebbe stata migliore data la migliore penetrazione dei farmaci grazie alla migliore ossigenazione dei tessuti rispetto alla situazione post resezione chirurgica. Si tratta di ragioni teoriche che devono trovare una conferma statistica dai diversi studi in corso che mettono a confronto il risultato delle due opzioni. C’è da dire che il paziente è generalmente orientato a preferire l’intervento immediato a quello posticipato a dopo la chemio(radio)terapia neoadiuvante.
4.CHEMIO(RADIO)TERAPIA NEI PAZIENTI CON TUMORE LOCALMENTE AVANZATO.
Un ulteriore problema riguarda quei pazienti in cui il tumore è ancora localizzato al pancreas ma non è resecabile perché infiltra strutture vascolari non asportabili con la sicurezza di una loro adeguata ricostruzione. In questo ambito si confrontano l’uso della sola chemioterapia con quello della chemioradioterapia. Uno studio ha dimostrato una sopravvivenza mediana di 9,2 mesi per la chemioterapia e di 11,1 mesi per la chemioradioterapia. Tuttavia il numero di pazienti inclusi nello studio è stato troppo piccolo per trarre una conclusione definitiva. In attesa dei risultati di ulteriori studi che facciano chiarezza su questo punto, è stato notato un aumento del numero di pazienti sottoposti a resezione chirurgica grazie alla riduzione del volume del tumore indotta dalla chemio(radio)terapia.
Purtroppo la maggior parte dei pazienti (circa l’80%) con carcinoma pancreatico giunge all’osservazione quando la malattia è già in fase avanzata e quindi non suscettibile d’intervento chirurgico con intento radicale. Tuttavia questi pazienti presentano spesso dei problemi di stenosi delle vie biliari e/o del duodeno che richiedono comunque una soluzione, in assenza della quale la sopravvivenza si accorcia anche notevolmente e la qualità della vita diviene insopportabile. Per questi pazienti esistono diverse opzioni, tra cui anche un intervento palliativo. L’asportazione del tumore, infatti, ha un senso solo se può essere radicale. In caso contrario è attualmente del tutto inutile oltre che inutilmente rischiosa. Elenchiamo qui di seguito le diverse opzioni per il trattamento palliativo del carcinoma pancreatico.
PROCEDURE PALLIATIVE
Quando non è possibile asportare il tumore e questo cresce ostruendo il dotto biliare principale (causando ittero) e/o il duodeno (bloccando il transito alimentare), abbiamo a disposizione diverse opzioni: la chirurgica palliativa, il trattamento endoscopico e il drenaggio trans epatico dell’albero biliare.
La chirurgia palliativa consiste nel creare un bypass (biliare e/o digestivo) senza rimuovere il tumore. Si utilizza un’ansa del piccolo intestino che viene abboccata allo stomaco eseguendo una gastro-enteroanastomosi o “bypass gastrico” (il cibo introdotto progredisce nel piccolo intestino saltando la parte di duodeno bloccata dal tumore). In modo analogo, si sutura un’ansa del piccolo intestino alla via biliare per creare una via di deflusso alternativa saltando l’ostacolo del tumore che ha determinato l’ittero. Questo intervento si chiama epaticodigiunostomia o “bypass biliare” ed è abitualmente associato al bypass gastrico nello stesso intervento anche in assenza di una stenosi duodenale.
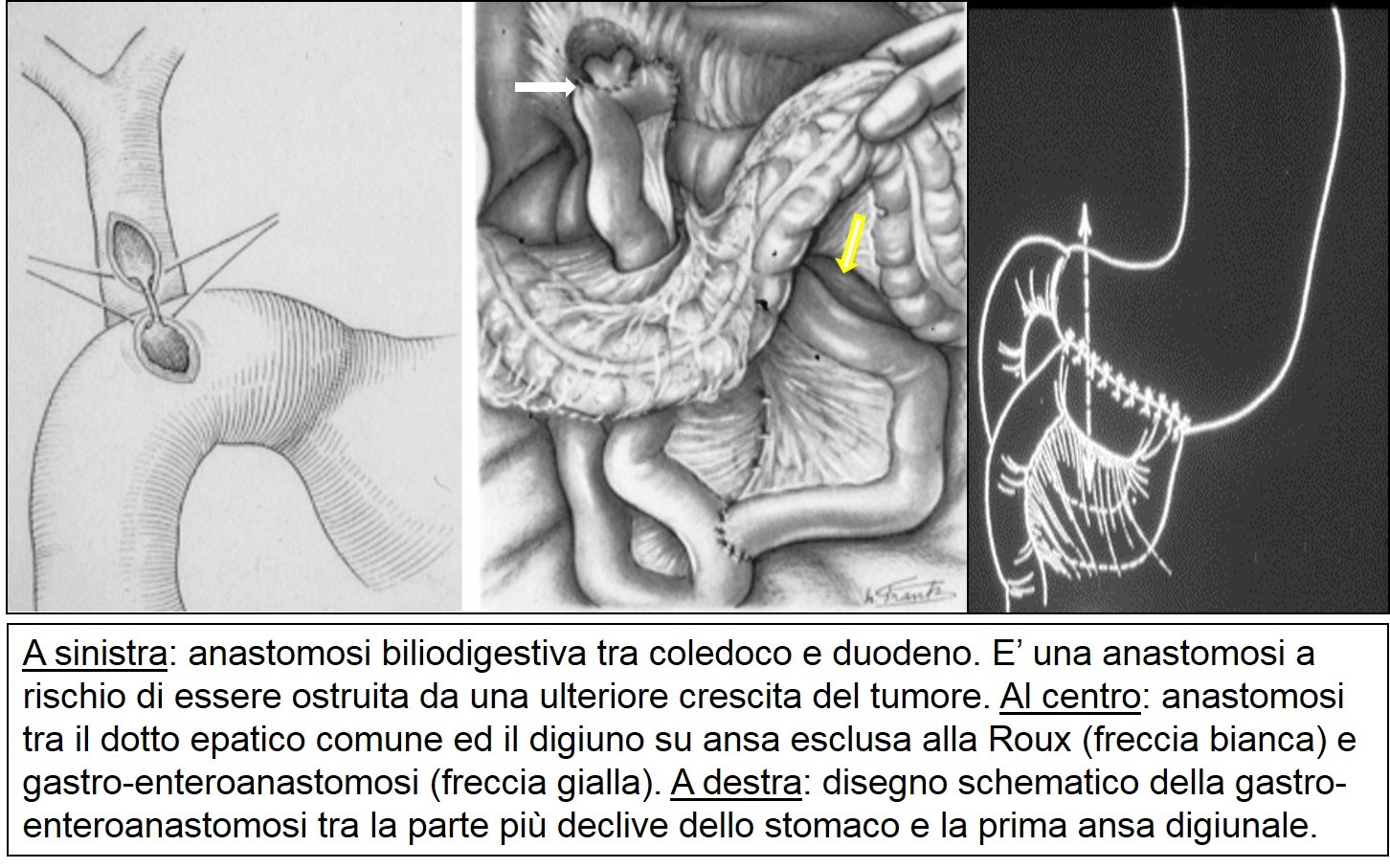
gastro-entero ed epatico digiuno
Il trattamento endoscopico consente di bypassare l’ostacolo al transito biliare e/o gastrico, con metodiche meno invasive. Con l’utilizzo di un endoscopio viene inserita una protesi (in pratica un tubo di materiale plastico o metallico chiamato“stent”) nell’albero biliare, e/o nel duodeno. Lo “stent” si espande progressivamente dilatando la stenosi e consentendo il passaggio della bile e/o del cibo.
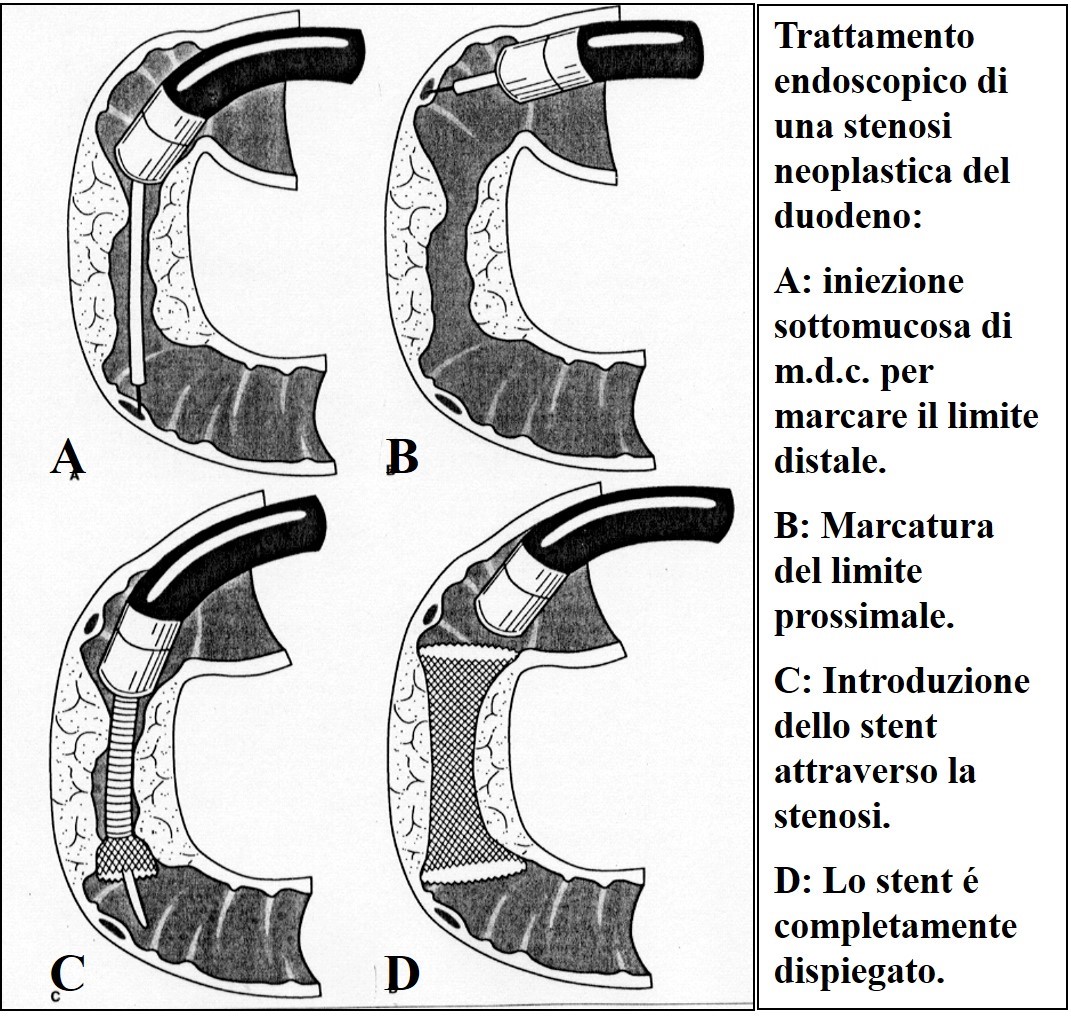
Posizionamento di endoprotesi per stenosi duodenale
Purtroppo la pervietà degli stent non dura tantissimo e si rende spesso necessaria la loro sostituzione (soprattutto dello stent biliare, poiché quello duodenale viene in genere posto in una fase molto avanzata della malattia).
Il drenaggio biliare percutaneo transepatico (PTBD) consente di bypassare solo l’ostacolo al transito biliare attraverso l’introduzione dello “stent” passando attraverso il fegato sotto controllo radiologico. (vedi quanto descritto in “COME VIENE FATTA LA DIAGNOSI E LA STADIAZIONE DEL CARCINOMA PANCREATICO?”). E’ una procedura decisamente più invasiva e rischiosa rispetto al trattamento endoscopico ed è indicata in caso di fallimento del tentativo endoscopico.
La scelta del trattamento più adatto al paziente, che offra il miglior beneficio con il minor rischio, è frutto della necessaria competenza ed esperienza e della disponibilità di risorse locali. La scelta è naturalmente basata sull’estensione della malattia e sulle condizioni generali del paziente.
INTERVENTI RESETTIVI (CON INTENTO RADICALE)
Una volta stabilito che il tumore è probabilmente resecabile, la scelta della sequenza del trattamento da proporre al paziente va concordata con l’Oncologo e con il paziente poiché esistono attualmente due correnti di pensiero purtroppo non ancora basate su prove certe: Alcuni ritengono che la via maestra sia l’exeresi chirurgica immediata seguita dalla chemioterapia associata o meno alla radioterapia. Altri ritengono che si debba prima procedere con la chemioterapia (eventualmente associata alla radioterapia) anche nei pazienti resecabili e sottoporre a intervento chirurgico solo i pazienti in cui il tumore, dopo alcuni cicli, sia ancora resecabile. Psicologicamente il paziente è di solito più propenso alla prima scelta. Sono in corso studi per definire quale delle due scelte sia la migliore ma i dati saranno disponibili tra qualche anno. Esistono tre tipi principali d’intervento chirurgico con intento curativo per i tumori pancreatici. La scelta dipende dalla sede e dall’estensione della neoplasia. Essi sono: la duodenocefalopancreasectomia, la pancreasectomia sinistra e la pancreasectomia totale.
La duodenocefalopancreasectomia (DCP) è l’intervento chirurgico più conosciuto per il carcinoma pancreatico ed è riservato ai tumori che interessano la testa dell’organo. E’ conosciuto anche come intervento di Whipple, chirurgo americano che ne descrisse la procedura nel 1935. In realtà la prima DCP è stata eseguita da Alessandro Codivilla nel 1898 a Imola. Purtroppo il paziente morì dopo ventiquattro giorni. Si tratta di un intervento tecnicamente molto complesso che prevede l’asportazione in blocco della testa del pancreas, del duodeno, della colecisti, del coledoco e, almeno nella versione originale, di una parte dello stomaco.
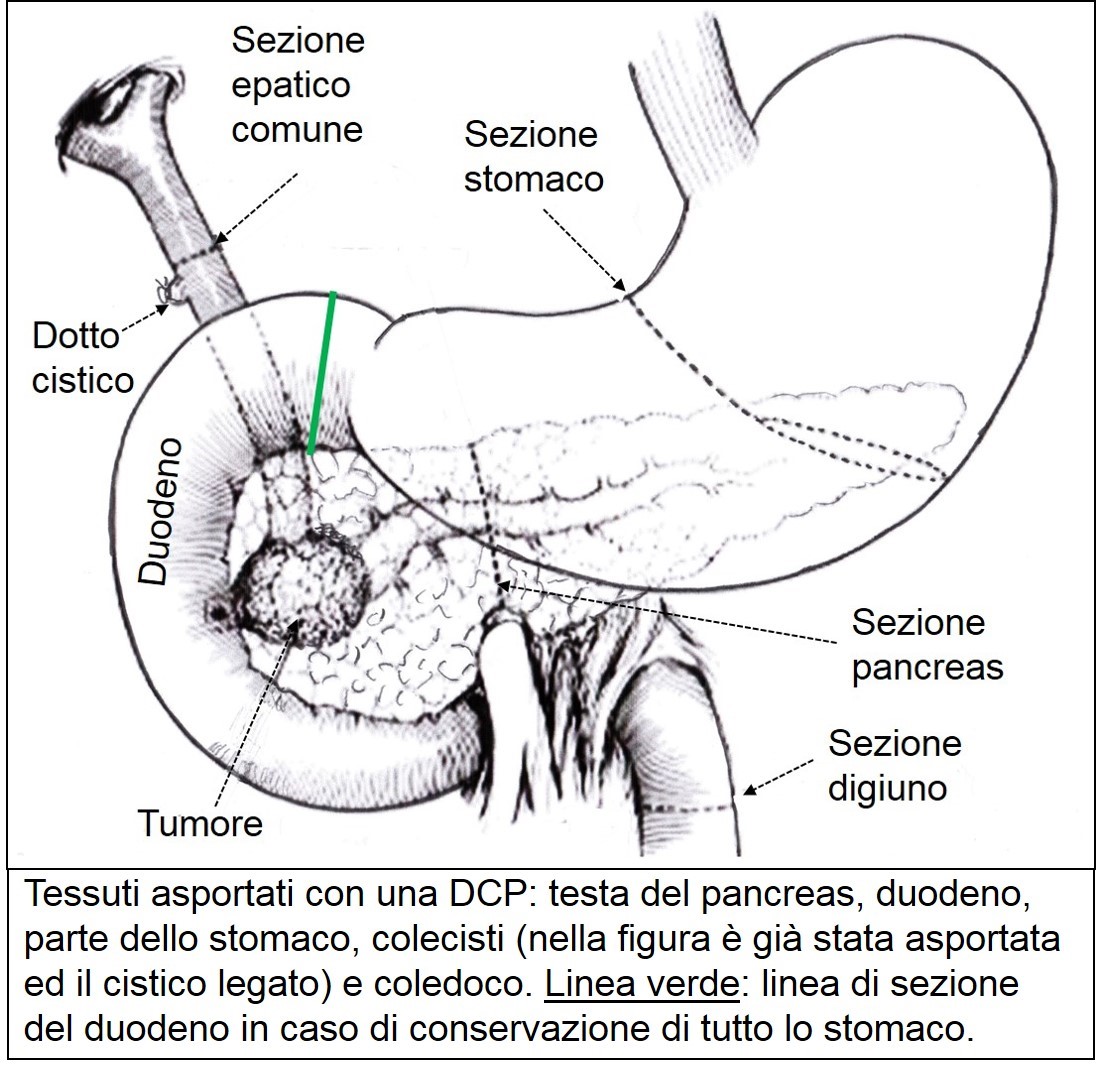
Tessuti asportanti mediante DCP
Dal lavoro pubblicato nel 1978 da Traverso Longmire, si preferisce conservare tutto lo stomaco con i primi 2 cm di duodeno; questo garantisce una più fisiologica ricostruzione della via digestiva e una migliore qualità di vita. Il restante pancreas, l’epatico comune e il duodeno residuo sono anastomizzati con il piccolo intestino.
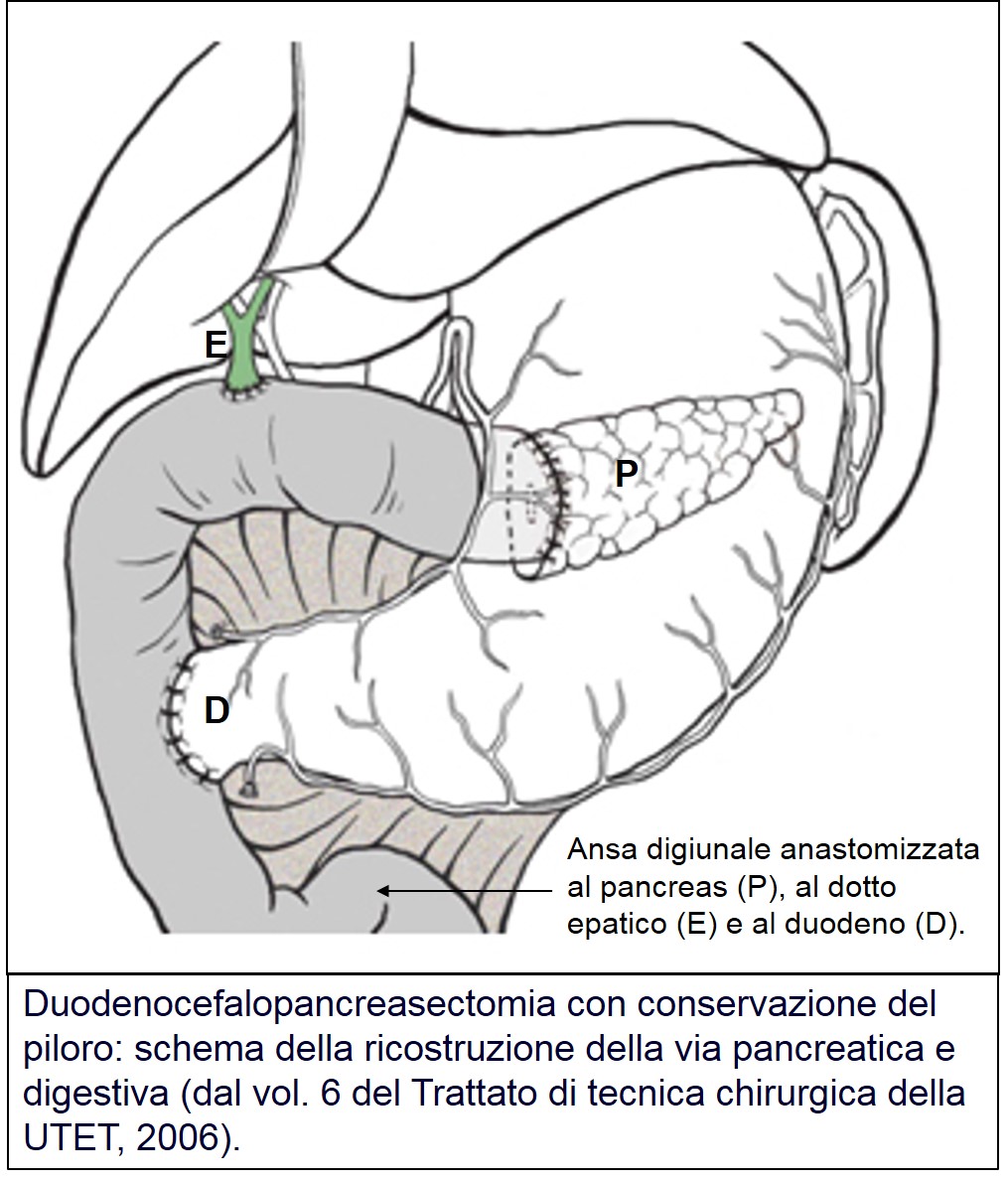
Ricostruzione dopo DCP
Questo formidabile intervento chirurgico è stato gravato fino alla fine degli anni ’80 del secolo scorso da un’elevata incidenza di complicanze e da una mortalità operatoria intorno al 20%, tanto che negli anni ’70 si sono levate voci autorevoli che ne criticavano l’applicazione in considerazione dei rischi elevati e degli scarsi benefici. Dall’inizio degli anni ’90 si è assistito a un progressivo calo della mortalità grazie ai progressi raggiunti in ambito chirurgico, medico e anestesiologico. La mortalità dopo DCP nelle mani di un chirurgo pancreatico esperto è attualmente molto bassa (0-3%) (Sosa JA et al. Importance of hospital volume in the overall management of pancreatic cancer. Ann Surg 1998; 228(3): 429-38). L’intervento dura in genere dalle sei alle otto ore.
In Centri particolarmente esperti, la stessa procedura può essere attualmente eseguita, oltre che con un’ampia incisione della parete addominale, in laparoscopia, eventualmente con l’aiuto del Robot. Questo consente di ridurre il trauma chirurgico, ma le complicanze post-operatorie, compresa la più pericolosa, la fistola pancreatica, hanno la stessa incidenza dell’intervento ad addome aperto.
La Pancreasectomia Sinistra è utilizzata per i carcinomi localizzati a livello del corpo-coda del pancreas. Si tratta di un intervento più semplice della DCP, ma è eseguito meno frequentemente a causa del ritardo con cui viene posta la diagnosi. Purtroppo il cancro del corpo-coda si manifesta clinicamente nella maggior parte dei pazienti quando non è più possibile un intervento con intento radicale. L’intervento consiste nell’asportazione di tutto il pancreas a sinistra della vena mesenterica assieme alla milza.
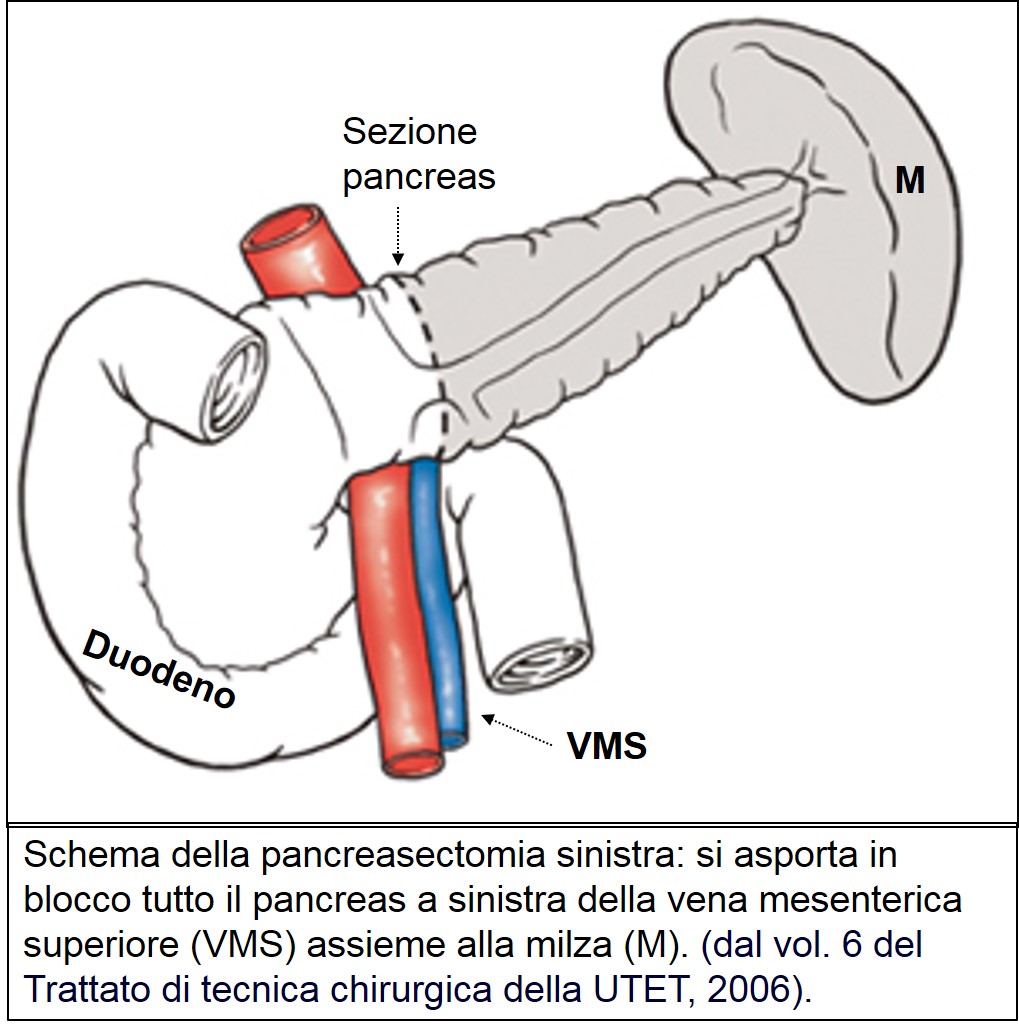
Pancreasectomia sinistra
Anche nel caso della pancreasectomia sinistra esiste la possibilità di eseguire l’intervento per via laparoscopica, eventualmente con l’aiuto del Robot.
La Pancreasectomia Totale è riservata ai casi in cui il tumore è esteso a tutto il pancreas. A differenza della duodenocefalopancreasectomia, viene asportato tutto il pancreas assieme alla colecisti, al coledoco, al duodeno e alla milza. Anche qui si può asportare parte dello stomaco oppure conservarlo intatto sezionando il duodeno subito a valle del piloro. La ricostruzione prevede pertanto due anastomosi invece di tre come per la DCP, poiché l’anastomosi pancreatica non è più necessaria. Bisogna sottolineare che è’ possibile vivere senza pancreas, anche se la gestione del diabete che consegue all’asportazione del pancreas è spesso difficile. Si tratta, infatti, di un diabete insulinoprivo, per cui è assolutamente necessario assumere insulina per il suo controllo. Inoltre è necessario assumere a ogni pasto una dose elevata di enzimi pancreatici per garantire la digestione degli alimenti.
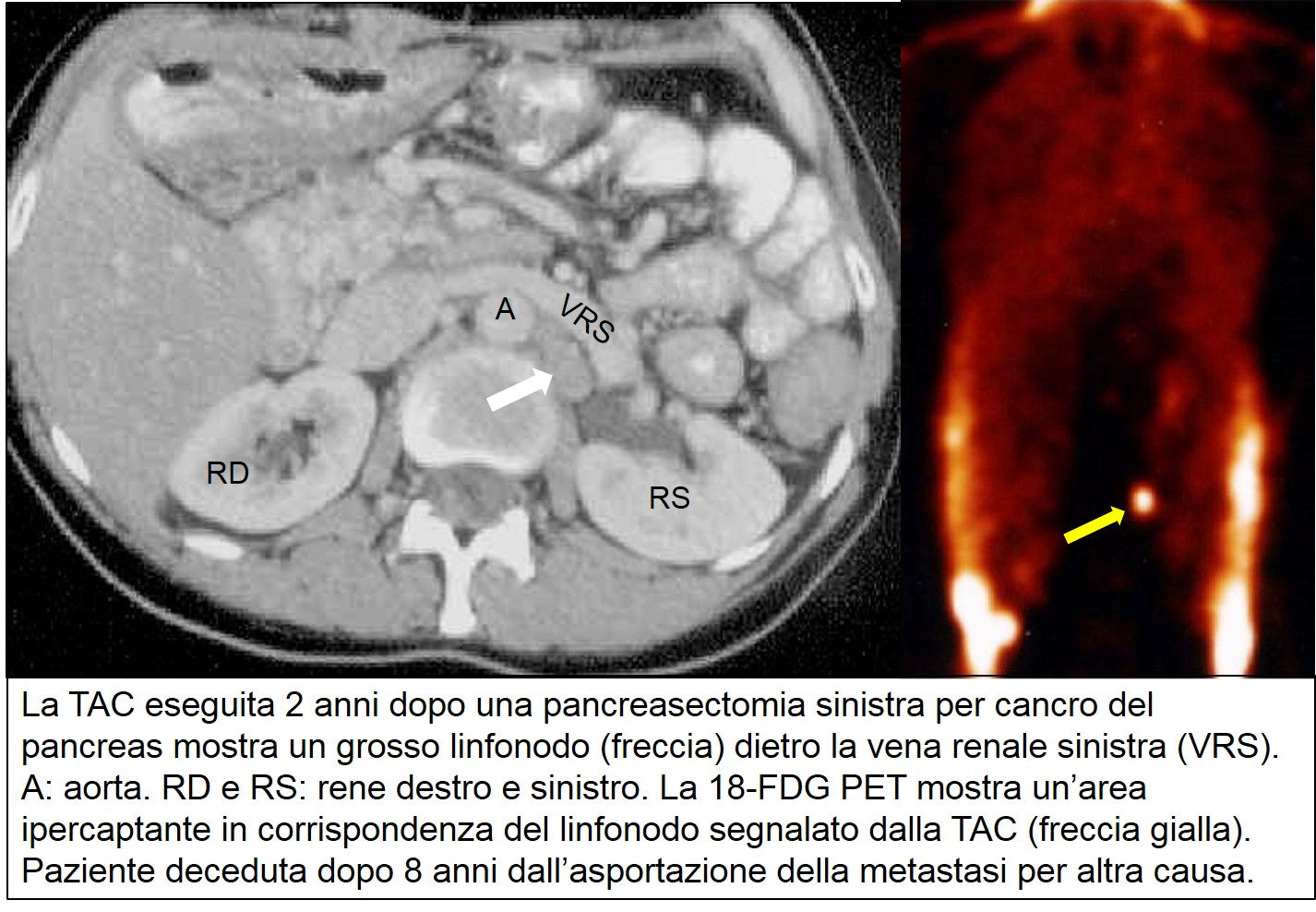
Come per ogni tipo di cancro, anche nel caso del carcinoma pancreatico è necessario eseguire una serie di esami programmati nel tempo per rilevare un’eventuale ripresa, locale e/o a distanza, della malattia. Il controllo trimestrale del marcatore tumorale specifico (CA 19-9, CEA, …) è utile solo se il marcatore era elevato prima dell’intervento. Ad esempio il dieci per cento circa dei pazienti con carcinoma pancreatico ha livelli preoperatori di CA 19-9 (il marcatore più sensibile e specifico) normali o bassi. Questo perché il paziente appartiene a quella parte, limitata, della popolazione che non è in grado di produrlo, oppure perché il tumore ha perso la capacità di produrlo. In questo caso il dosaggio del marcatore nel follow-up risulta di scarsa utilità. Al dosaggio dei marcatori specifici si possono associare la radiografia del torace e l’ecografia addominale ogni sei mesi, alternati con la TAC toraco-addominale ogni sei mesi per i primi due anni. Un aumento significativo dei marcatori deve suggerire di ricercare accuratamente la sede di probabile ripresa della malattia. In casi particolari la 18-FDG PET può essere utile per dirimere il dubbio che una lesione sospetta sia dovuta o meno a recidiva. Oltre i due anni, i controlli possono essere programmati meno intensamente nel tempo.
In caso di ripresa della malattia, il paziente è affidato all’Oncologo per il trattamento chemio(radio)terapico stabilito sulla base della sede e dell’estensione della ripresa di malattia. Raramente la ripresa della malattia avviene in una sede limitata accessibile al trattamento chirurgico che, in questo caso, diventa il trattamento di scelta
Follow-up KP
CARCINOMA DEL PANCREAS EREDO-FAMILIARE
Lo studio del genoma umano ha permesso di individuare molti dei meccanismi molecolari che portano allo sviluppo dei tumori, compreso quello pancreatico. E’ stata documentata un’incidenza progressivamente crescente di mutazioni sia a livello di oncogeni (geni che favoriscono la trasformazione neoplastica delle cellule) che di geni oncosoppressori (geni che controllano la crescita cellulare impedendo la moltiplicazione e favorendo l’autodistruzione delle cellule che hanno subito alterazioni favorenti l’insorgenza del cancro) nelle lesioni precancerose che possono formarsi ed eventualmente progredire all’interno del pancreas.
I principali geni nucleari mutati nella maggior parte delle cellule tumorali pancreatiche sono l’oncogene KRAS, e gli oncosoppressori TP53, SMAD4 and CDKN2A. A questi si aggiungono diverse mutazioni di gruppi più o meno numerosi di geni che contribuiscono a definire le caratteristiche di maggiore o minore aggressività del tumore, alla tendenza a produrre mutazioni in altri geni, alla maggiore o minore sensibilità alla chemio-radioterapia.
Alcune mutazioni genetiche sono state riconosciute come causa di un aumentato rischio di sviluppare il carcinoma del pancreas e circa il 10% dei casi di cancro del pancreas sembra essere su base eredo-familiare.
Si distinguono due gruppi di individui ad alto rischio su base eredo-familiare:
1) Individui con una sindrome (o mutazione) genetica accertata (3% dei casi):
- pancreatite ereditaria (geni SPINK1, PRSS1, CTRF o CTRC)
- sindrome familiare da mole-melanomi atipici multipli (FAMMM) (geni CDKN2A, p16-Leiden)
- sindrome di Peutz-Jeghers (geni LKB1/STK11)
- sindrome del cancro ereditario della mammella e dell'ovaio (geni BRCA1/BRCA2)
- sindrome di Lynch (HNPCC) (geni MLH1, MSH2, MSH6)
- sindrome di LiFraumeni (gene p53)
- mutazione del gene PALB2
2) individui con cancro del pancreas familiare (7% dei casi), per i quali si sospetta una suscettibilità ereditaria, data la presenza di almeno due familiari di primo grado con carcinoma del pancreas. Il genetista, mediante test genetici specifici, può identificare quali individui con familiarità per cancro del pancreas siano in realtà portatori di mutazioni ereditarie.
SORVEGLIANZA E TRATTAMENTO
Come molti tumori, il cancro del pancreas si sviluppa lentamente e in stadi progressivi. Le cellule del pancreas normale possono trasformarsi in lesioni benigne e queste lesioni iniziali possono trasformarsi in cellule maligne, che possono poi moltiplicarsi e dare infine origine al carcinoma. Lo scopo della sorveglianza per il cancro del pancreas è identificare le lesioni benigne, prima che divengano carcinoma, oppure diagnosticare il cancro allo stadio più precoce, quando ancora vi sia una possibilità di cura. Anche se al momento non ci sono linee guida ufficiali per la sorveglianza del cancro del pancreas, si possono sottoporre a sorveglianza gli individui ritenuti maggiormente a rischio per cause eredo-familiari. La strategia più comune prevede indagini strumentali periodiche, quali la risonanza magnetica (RM) e/o l’ecoendoscopia, e al momento è proposta solo agli individui ad alto rischio e in un contesto di ricerca clinica.
Il trattamento chirurgico è l’unica possibilità di cura per il cancro del pancreas. La possibilità di un trattamento chirurgico preventivo (asportazione di parte o tutta la ghiandola) nei pazienti con familiarità per cancro del pancreas è ancora oggetto di studio.
