Le cisti e i tumori cistici del Pancreas
Le lesioni cistiche del pancreas costituiscono un gruppo eterogeneo di patologie, alcune di recente definizione, con comportamento biologico molto vario. L’incidenza di tali formazioni appare in continuo aumento, grazie anche alla diffusione dell’ecografia e della TAC addominale.
E’ sempre più frequente il riscontro occasionale di una o più lesioni cistiche del pancreas in pazienti asintomatici. Un’adeguata conoscenza ed esperienza di questo tipo di patologia è indispensabile per il corretto inquadramento delle lesioni e per la scelta del tipo di trattamento da mettere in atto in questi pazienti.
Era la lesione cistica più frequente del pancreas (75%) fino alla fine del secolo scorso. Attualmente prevalgono ampiamente i tumori cistici (vedi più avanti). Si tratta di una lesione invariabilmente benigna che riconosce nella maggior parte dei casi un’origine infiammatoria (pancreatite acuta o cronica) o traumatica. Rare sono le pseudocisti “da ritenzione”, dovute all’ostruzione parziale del dotto principale pancreatico da parte di un tumore benigno o maligno. Colpisce più frequentemente il sesso maschile con un rapporto maschi/femmine di 2/1 – 3/1. E’ costituita da una raccolta di succo pancreatico delimitata da una parete neoformata costituita in parte dai visceri circostanti e in parte da tessuto fibroso. La parte fibrosa della parete richiede almeno 4-6 settimane per diventare solida a sufficienza per un eventuale trattamento chirurgico. Il diametro delle pseudocisti può andare da uno a 20-30 cm. Il contenuto è costituito da succo pancreatico più o meno puro e, soprattutto nelle pseudocisti post pancreatite acuta, da materiale necrotico-emorragico in quantità variabile, abitualmente scarsa. Può essere singola o multipla (anche 5-6) e si trova con una frequenza leggermente maggiore nel corpo-coda del pancreas, ma può interessare tutte le diverse porzioni della ghiandola. L’incidenza di pseudocisti dopo un attacco di pancreatite acuta è approssimativamente del 2 – 3%, mentre nella pancreatite cronica compare nel 15 – 30% dei pazienti.
Il quadro clinico è caratterizzato dal classico dolore pancreatico irradiato al dorso (il dolore può, tuttavia, essere assente o andare dal senso di peso o di fastidio, a un dolore anche intenso che si accentua dopo i pasti). Eventuali compressioni sui visceri circostanti possono comportare ittero per compressione delle vie biliari oppure nausea e/o vomito in caso di compressione dello stomaco, duodeno o intestino.
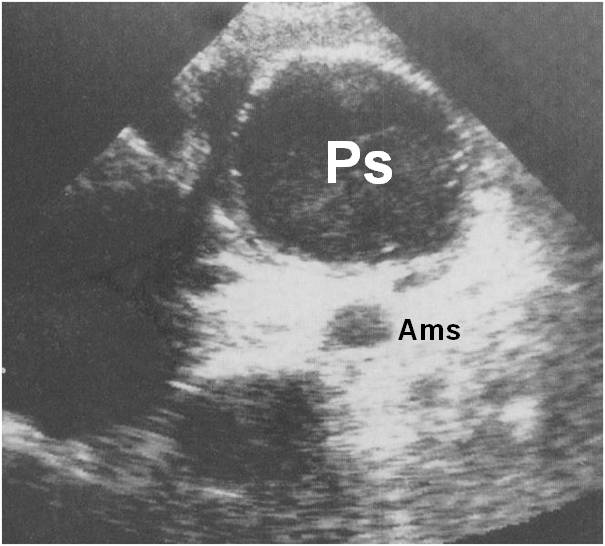
Ecografia di pseudocisti (Ps) del corpo del pancreas. E’ visibile l’arteria mesenterica superiore (Ams)
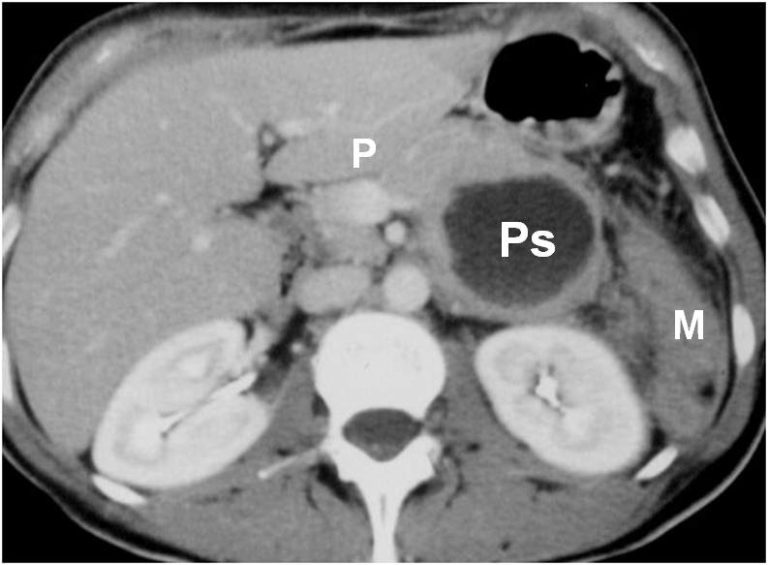
TAC addome con mdc di pseudocisti (Ps) al passaggio corpo-coda del pancreas. P = Pancreas; M = milza.
La comparsa di complicanze è fortunatamente rara. Tra le complicanze annoveriamo la rottura con possibile formazione di ascite pancreatica, l’infezione con possibile formazione di un ascesso, l’emorragia nell’apparato digerente attraverso uno dei diversi meccanismi possibili, la stenosi delle vie biliari con ittero o delle vie digestive con nausea e vomito.
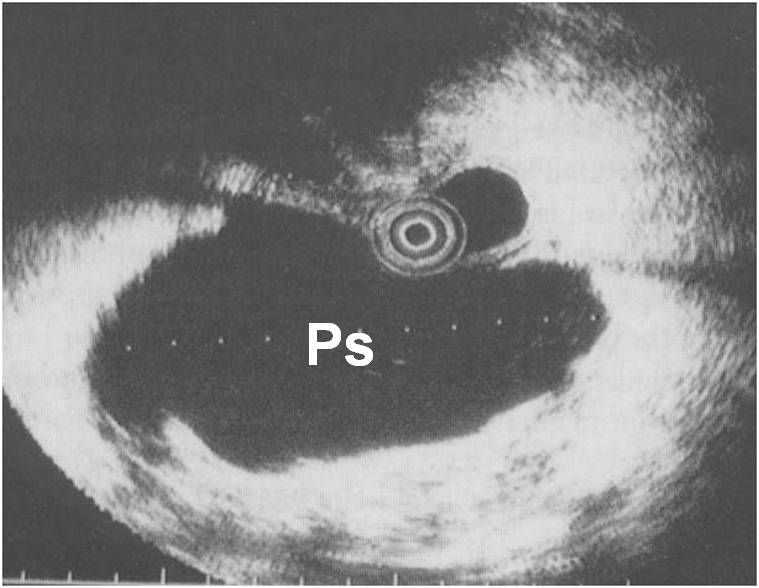
Ecoendoscopia: Visualizzazione di una voluminosa pseudocisti pancreatica.
La diagnosi può essere semplice in presenza di una storia clinica caratteristica (precedente pancreatite acuta o cronica, trauma addominale), mentre può diventare difficile la diagnosi differenziale con i tumori cistici in caso di lesione cistica in pazienti in cui non sono documentabili i fattori predisponenti noti. Per la visualizzazione della lesione sono abitualmente utilizzate l’ecografia, la TAC e la RMN. Quest’ultima consente di visualizzare anche i dotti pancreatici e il loro rapporto con la pseudocisti. Per quanto riguarda la terapia si deve tener presente che la maggior parte delle pseudocisti di diametro inferiore a 5 cm si risolve spontaneamente nel tempo e quindi necessitano solo di essere tenute sotto osservazione. In caso di pseudocisti voluminose o che aumentano progressivamente di volume o che siano sintomatiche (per compressione degli organi circostanti) è necessario sottoporle a trattamento che può a sua volta essere chirurgico o endoscopico o, più raramente, percutaneo sotto guida radiologica. Il trattamento con somatostatina può consentire di accelerare la risoluzione del problema per le pseudocisti fino a 5 cm ma soprattutto può essere molto utile nei casi in cui l’esecuzione dell’intervento deve essere procrastinata in attesa della maturazione della parete della pseudocisti per poter procedere al trattamento definitivo. Il trattamento endoscopico consiste nel creare una comunicazione diretta tra la pseudocisti e lo stomaco o il duodeno mediante un endoscopio appositamente attrezzato. In questi casi è utile la valutazione eco endoscopica della parete intestinale dove deve avvenire l’incisione per evitare di ledere vasi sanguigni di un certo calibro durante la procedura. Il trattamento endoscopico è sconsigliato in caso di presenza di abbondanti residui necrotici nella pseudocisti (per il rischio di trasformare la pseudocisti in ascesso in caso d’inadeguata toilette) o di complicanze (infezione, sanguinamento, ecc.) cui sia andata incontro la pseudocisti. E’ comunque opportuno, se possibile, attendere la maturazione della parete della pseudocisti. Il trattamento chirurgico consiste nell’ampia apertura della pseudocisti che viene adeguatamente svuotata e quindi anastomizzata allo stomaco o all’intestino. Dopo il trattamento si assiste alla progressiva scomparsa della pseudocisti.
I tumori cistici del pancreas includono diverse forme di relativamente recente identificazione: il cistoadenoma sieroso, il cistoadenoma mucinoso, la Neoplasia Papillare Mucinosa Intraduttale (IPMN) e il tumore solido pseudopapillare. Come vedremo, la probabilità di trasformazione maligna è molto bassa per il cistoadenoma sieroso mentre è più elevata per le due lesioni mucinose.
Si tratta di una neoplasia cistica a contenuto sieroso le cui pareti sono rivestite da cellule uniformi, cuboidali, ricche di glicogeno. Nella forma tipica è costituita da numerosissime cisti di dimensioni millimetriche (adenoma microcistico) aderenti tra loro a formare una massa più o meno voluminosa con una cicatrice stellata centrale. Esistono anche forme atipiche, in cui le numerose cisti possono assumere dimensioni superiori ai 2 cm (adenoma macrocistico) o infine essere costituite da una o poche cisti voluminose (adenoma oligocistico).
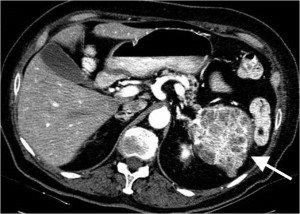
TAC addome. E’ evidente un cistoadenoma sieroso tipico della coda del pancreas (indicato dalla freccia).
Questo tipo di neoplasia è quasi sempre benigna, anche se sono stati riportati casi sporadici di malignità. I cistoadenomi sierosi possono essere associati alla sindrome di von Hippel-Lindau (vedi il capitolo specifico), malattia ereditaria autosomica dominante, caratterizzata da tumori del sistema nervoso centrale e della retina (emangioblastomi), neoplasie e/o cisti renali, feocromocitomi.
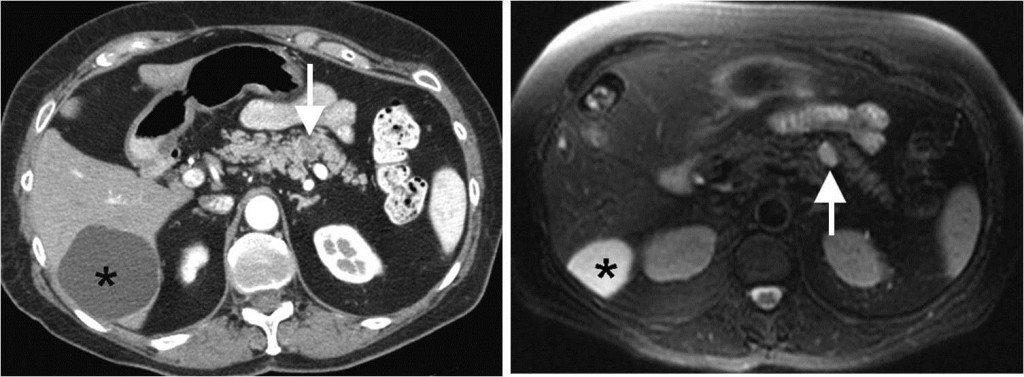
TAC addome (a sinistra) e RMN di un piccolo cistoadenona oligocistico del corpo del pancreas (indicato dalle frecce).
Le lesioni pancreatiche compaiono in genere prima delle lesioni del sistema nervoso centrale. Il quadro clinico può essere del tutto silente o essere caratterizzato da modesto dolore e, specie nelle forme più voluminose, da segni di compressione su stomaco, duodeno e vie biliari (digestione difficile, nausea, vomito, raramente ittero). Per la visualizzazione della lesione sono abitualmente utilizzate l’ecografia, la TAC e la RMN. La diagnosi è facile nelle forme tipiche. Nel caso invece dell’adenoma macrocistico o oligocistico si pongono difficili problemi di diagnosi differenziale con le neoplasie mucinose (cistoadenoma mucinoso e IPMN) la cui potenzialità di evoluzione maligna è molto maggiore. Il cistoadenoma sieroso tipico e asintomatico non richiede alcuna terapia; la semplice osservazione costituisce l’opzione di scelta. Il trattamento chirurgico si rende necessario solo per i pazienti sintomatici o in caso di dubbio diagnostico rispetto alle neoplasie mucinose o ad altre lesioni potenzialmente o francamente maligne. Deve essere comunque attentamente valutato il rischio chirurgico per asportare una patologia benigna.
Il cistoadenoma (e il cistoadenocarcinoma) pancreatico è un tumore composto di cellule che producono mucina e che tappezzano le pareti, ed eventuali setti fibrosi, della cisti. Caratteristica peculiare di questo tumore è la presenza di uno stroma ovarico (simile a quello dei tumori dell’ovaio) a livello della capsula. Le cellule epiteliali neoplastiche formano una o più cisti, divise da setti fibrosi, contenenti un fluido viscoso, ricco di muco. Una caratteristica fondamentale è che la cisti che costituisce il tumore non comunica con il dotto pancreatico principale. Questo tipo di neoplasia colpisce quasi esclusivamente il sesso femminile ed è tipicamente localizzata a livello del corpo-coda del pancreas. L’evoluzione naturale di questa neoplasia prevede il progressivo lento passaggio dalla forma benigna (cistoadenoma mucinoso), alla forma in fase di trasformazione maligna ma non ancora maligna (cistoadenoma mucinoso con displasia lieve o moderata) alla forma francamente maligna (cistoadenocarcinoma mucinoso).
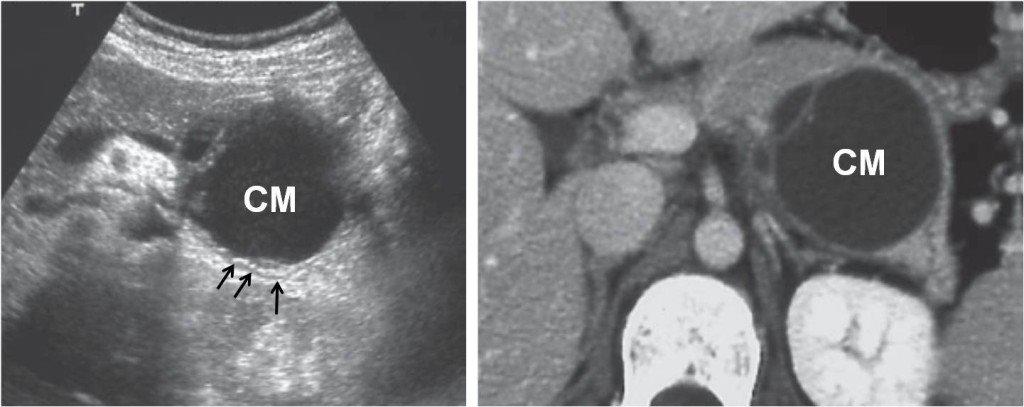
Ecografia (a sinistra) e TAC addome di un cistoadenoma mucinoso (CM) del corpo-coda del pancreas. Le frecce indicano il Wirsung che decorre a contatto con il tumore.
Questo tipo di sequenza evolutiva è tipico di tutti i tumori che producono mucina, poiché è stata documentata la possibilità di progressione delle forme benigne fino al carcinoma invasivo (sequenza adenoma, tumore borderline, carcinoma in situ, carcinoma invasivo) basata sul grado di atipia citologica e strutturale delle cellule epiteliali. La diagnosi si basa su un quadro clinico silente o piuttosto sfumato (senso di peso o di fastidio all’addome superiore, talora irradiato al dorso, disturbi dell’appetito e/o della digestione) tanto che la scoperta avviene quasi sempre per caso a seguito di un’ecografia addominale eseguita per altri motivi.
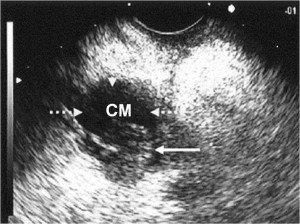
Ecoendoscopia: si osserva un cistoadenocarcinoma mucinoso (CM) del corpo-coda del pancreas. La freccia lunga indica la crescita del tumore maligno all’esterno della capsula del tumore indicata dalle altre frecce.
La visualizzazione della lesione cistica è abbastanza agevole mediante l’ecografia e la TAC dato il volume abitualmente rilevante. Diverso è il discorso riguardante la diagnosi differenziale con le pseudocisti (nel caso manchi la storia di pancreatite o trauma) e con le neoplasie papillari mucinose intraduttali (IPMN) dei dotti secondari che tuttavia comunicano con il dotto principale pancreatico (Wirsung). Per la dimostrazione della comunicazione è utile la Wirsung-RMN possibilmente con stimolo secretinico. Utile è l’ecoendoscopia che consente di escludere (o dimostrare) la comunicazione con il Wirsung oltre a consentire un prelievo del contenuto del tumore. La terapia di questo tumore è chirurgica ogniqualvolta possibile e consiste nell’asportazione della porzione di ghiandola contenente la lesione. La guarigione definitiva è garantita per le lesioni benigne, borderline e anche per le forme maligne a patto che non abbiano ancora superato i limiti della capsula del tumore o non abbiano dato metastasi.
Descritte per la prima volta dai Colleghi Giapponesi nel 1982, costituiscono delle forme neoplastiche di definizione relativamente recente. Sono caratterizzate dalla formazione di proiezioni papillari più o meno voluminose rivestite da cellule che producono mucina. Possono essere localizzate all’interno del dotto principale (IPMN del dotto principale) o dei dotti secondari (IPMN dei dotti secondari), o di entrambi (IPMN misti)(vedi la figura). Il risultato è la dilatazione dei dotti interessati o la loro parziale ostruzione con formazione di lesioni cistiche più o meno voluminose. Generalmente questi tumori insorgono in pazienti anziani di entrambi i sessi, anche se la diffusione degli esami d’immagine, e l’esperienza acquisita, ne consente la rilevazione anche in pazienti relativamente giovani e asintomatici. E’ documentata una correlazione fra tumori papillari mucinosi intraduttali e neoplasie d’altri organi oltre che della comparsa di un carcinoma pancreatico indipendente dall’IPMN sia pure con un rischio/anno intorno a 0,41%. La sede d’insorgenza può interessare tutto il pancreas, anche se l’incidenza è più elevata nella testa-processo uncinato dell’organo e a livello del dotto principale. Anche questi tumori sono classificati in base al livello d’atipia cellulare che esibiscono: adenoma, tumore borderline, carcinoma in situ, carcinoma invasivo. La probabilità di arrivare nel tempo alla trasformazione maligna è circa doppia per le IPMN che interessano il dotto principale rispetto a quelle che colpiscono solo i dotti secondari (65% verso 30% circa). Quadro clinico: il 20% circa dei pazienti sono asintomatici e scoperti in corso d’indagini per altra patologia.
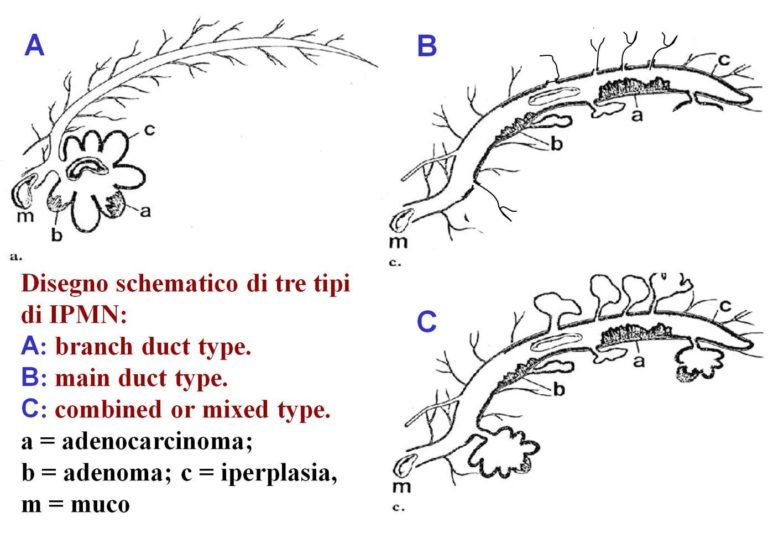
Rappresentazione schematica dei tre tipi di IPMN. La forma A (dei dotti secondari) può interessare uno o più dotti in qualsiasi area del pancreas. La forma C (mista, del dotto principale e dei dotti secondari) ha per caratteristica l’associazione di lesioni sia del dotto principale sia di quelli secondari. La forma B (del dotto principale) interessa solo il Wirsung ed eventualmente il Santorini.
Il dolore è presente nel 50% dei casi ed è irradiato al dorso nel 10%. Il 43% presenta calo ponderale, il 22% diarrea (steatorrea), il 17-18% ittero, il 16% episodi di pancreatite, il 15% diabete (esordio o peggioramento di un diabete preesistente), astenia (13%), anoressia o nausea/vomito (11%), più rare febbre, sazietà precoce, stipsi, sintomi influenzali.
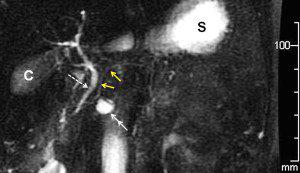
Wirsung RMN in paziente con IPMN dei dotti secondari della testa del pancreas (freccia bianca). Si vedono distintamente il Wirsung (frecce gialle). Il coledoco (freccia tratteggiata bianca), la colecisti (C) e lo stomaco (S).
La diagnosi si basa sulla sintomatologia, quando presente. Responsabile dei sintomi è la produzione di muco da parte della neoplasia, produzione che può essere così abbondante da essere visibile fuoriuscire dall’ampolla di Vater (comunicazione dei dotti biliare e pancreatico con il duodeno) durante un esame endoscopico.
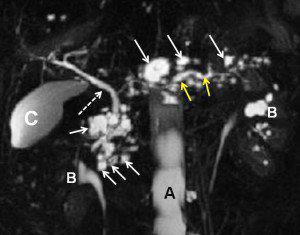
Colangio-Wirsung RMN di un paziente con IPMN. Si tratta di un IPMN dei dotti secondari, con le caratteristiche formazioni “a grappolo” (frecce bianche) lungo il Wirsung (frecce gialle), con il quale sono in comunicazione. La freccia bianca tratteggiata indica il coledoco. C = colecisti; B = bacinetti renali.
Il muco tende a ostruire parzialmente i dotti provocando i disturbi lamentati dal paziente. La visualizzazione è soprattutto radiologica (ecografia, TAC, RMN con Wirsung RMN) che permettono di dimostrare l’eventuale dilatazione del dotto principale contenente mucina nelle IPMN del dotto principale o miste oppure una o più lesioni cistiche (talora numerose) comunicanti con il sistema duttale pancreatico.
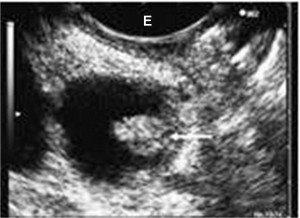
Ecoendoscopia di un IPMN dei dotti secondari con nodulo parietale (freccia).
E = eco endoscopio.
La presenza di noduli parietali aumenta la probabilità di trasformazione maligna.
In alcuni pazienti la gastroduodenoscopia può dimostrare la fuoriuscita di muco dalla papilla di Vater dilatata a bocca di pesce. L’ERCP è stata utilizzata per dirimere i casi dubbi e per raccogliere campioni di materiale per l’esame citologico. Nelle lesioni dei dotti periferici è utile l’ecoendoscopia per documentare o escludere la comunicazione della lesione con il Wirsung. La diagnosi differenziale si pone soprattutto con i cistoadenomi mucinosi che tuttavia non comunicano con il sistema duttale, sono dotati di uno stroma ovarico, insorgono generalmente nel corpo-coda del pancreas e in donne di mezza età. Le indicazioni al tipo di terapia sono notevolmente cambiate negli ultimi anni. Mentre all’inizio la semplice diagnosi di IPMN implicava l’intervento chirurgico resettivo, ora molti pazienti sono invece posti in follow-up.
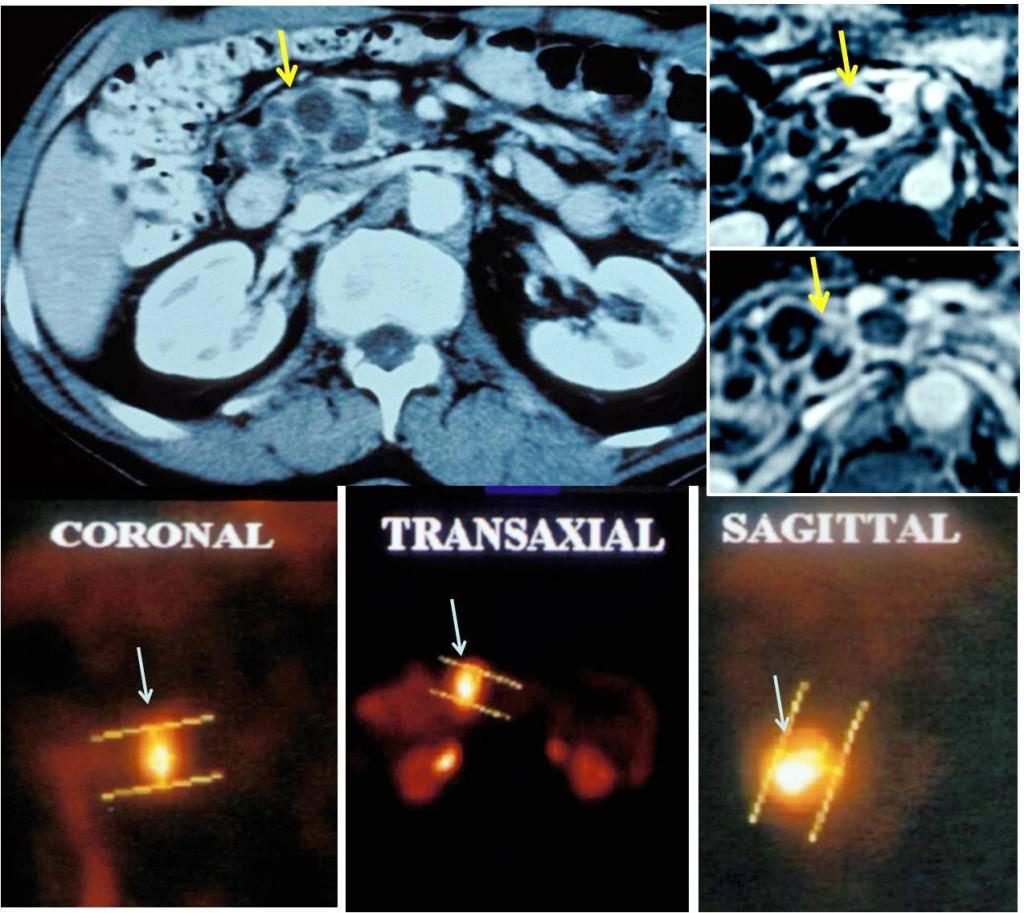
18 FDG PET TAC di un paziente con IPMN dei dotti secondari della testa del pancreas dimostrato dalla TAC (immagine intera e due dettagli, frecce gialle). La PET positiva (frecce bianche) corrisponde all’esame istologico a un cancro in situ. L’intervento chirurgico è stato curativo.
Per la scelta della terapia vanno presi in considerazione il rischio di malignità (elevato nelle IPMN che coinvolgono il dotto principale), la spettanza di vita del paziente e il rischio chirurgico. Mentre nei soggetti relativamente giovani e a basso rischio chirurgico prevale la scelta legata alla probabilità (bassa o elevata) di trasformazione maligna (poiché una volta diventato maligno si comporta come il cancro del pancreas), nei pazienti anziani e/o ad alto rischio, è di fondamentale importanza la differenziazione tra neoplasie benigne e maligne per limitare l’esposizione al rischio chirurgico di pazienti con IPMN benigni. L’attendibilità delle indagini morfologiche (ECO, TAC, RMN, ed Ecoendoscopia con prelievo del liquido della cisti) in questo campo non supera l’80%. A livello internazionale è stato raggiunto l’accordo per considerare potenzialmente maligna e quindi da asportare una IPMN in caso di ittero ostruttivo e presenza di una lesione cistica nella testa del pancreas, quando interessa il dotto principale con diametro del dotto superiore a 10 mm, quando la TAC o la RMN rileva al suo interno la presenza di una componente solida che prende contrasto. Sono stati inoltre definiti una serie di aspetti morfologici che suggeriscono il rischio di malignità cui tuttavia corrisponde una elevata percentuale di IPMN ancora benigne.
Abbiamo recentemente dimostrato che la PET, e la PET-TC, con 18FDG ha un’attendibilità superiore al 90%. Negli ultimi anni quest’indagine è diventata il nostro punto di riferimento per decidere il trattamento da proporre ai pazienti anziani e/o ad alto rischio. Non esiste un trattamento medico, ma i pazienti posti in follow-up devono essere sottoposti a controlli morfologici e al dosaggio del CA 19-9 ogni 6-12 mesi che possono allungarsi a 24 mesi per le lesioni stabili nel tempo. Il trattamento chirurgico delle IPMN prevede la resezione più o meno estesa del pancreas in relazione all’estensione del coinvolgimento duttale pancreatico.
Si tratta di un tumore raro che colpisce abitualmente il sesso femminile con picco d’incidenza tra i venti e i trenta anni. Esso ha un decorso in genere indolente, con bassa aggressività biologica. E’ composto da una massa solida, abitualmente voluminosa, che può mostrare una degenerazione cistica ed emorragie al suo interno. L’insorgenza in donne giovani ha suggerito una relazione con gli ormoni sessuali femminili che, tuttavia, non è mai stata definitivamente confermata. E’ conosciuto con diversi nomi: tumore solido-papillare, tumore cistico-papillare, tumore solido-cistico, e neoplasia epiteliale solida, cistica e papillare. Il quadro clinico è di solito poco indicativo. Può dare senso di peso o di fastidio o modesto dolore nel 45% circa delle pazienti, massa palpabile nel 35% circa e percentuali irrilevanti (3-5%) di nausea, vomito, febbre, calo ponderale. La scoperta del tumore è spesso casuale legata ad indagini eseguite per altri motivi. Per la visualizzazione della lesione sono abitualmente utilizzate l’ecografia, la TAC e la RMN. La diagnosi è radiologica anche se non è sempre facile la diagnosi differenziale con altre lesioni cistiche del pancreas.
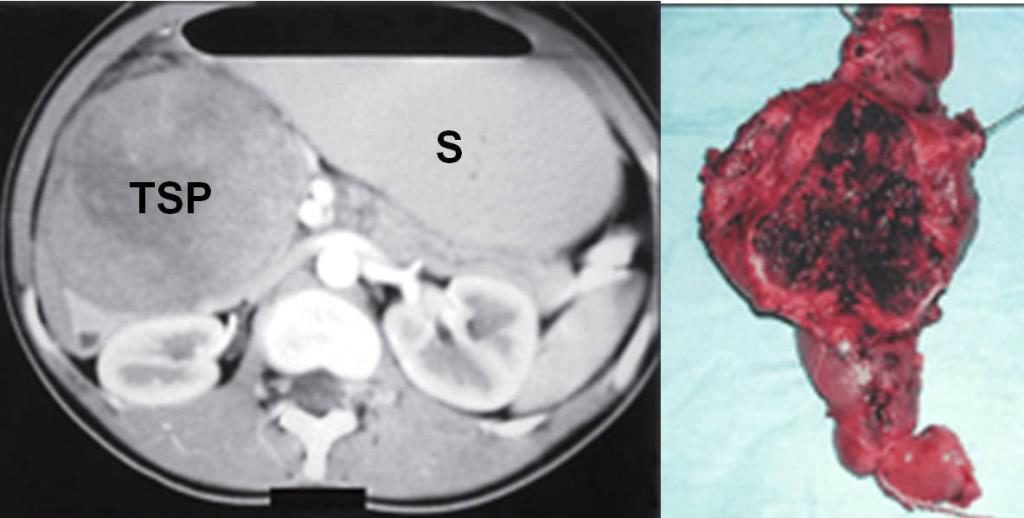
A sinistra la TAC addome di una paziente con tumore solido pseudo papillare della testa del pancreas (TSP). A destra il pezzo operatorio con il tumore aperto in cui è visibile la componente emorragica. S = Stomaco.
La terapia di scelta è chirurgica e consiste nella resezione pancreatica con asportazione radicale della neoplasia. In un piccolo numero di pazienti è possibile riscontrare, al momento della diagnosi, un quadro d’invasione locale o la presenza di metastasi a distanza. Anche in questi casi è comunque indicato un trattamento chirurgico aggressivo, se tecnicamente possibile, perché può prolungare la sopravvivenza. La recidiva della malattia dopo asportazione del tumore primitivo è un evento raro ma possibile. Anche in questo caso è auspicabile un trattamento chirurgico ogniqualvolta possibile. L’efficacia della chemioterapia e/o radioterapia non è conosciuta a causa dell’esperienza molto limitata disponibile. Una lunga sopravvivenza è stata riportata anche in presenza di metastasi a distanza.
